ABPP-Analyse enthüllt neuen entzündungshemmenden Mechanismus von Itaconsäure über Protein-Metabolit-Wechselwirkungen
Die Rolle von Itaconat, einem endogenen Metaboliten, der für Entzündungen und die Immunregulation entscheidend ist, wird in einem gemeinsamen Papier des ChomiX Biotech-Teams erläutert. Die Studie nutzte auf innovative Weise die ABPP-Technologie, um zu zeigen, dass Itaconat die S-Glykosylierung von Cysteinresten an wichtigen glykolytischen Enzymen verändert und dadurch den Zellstoffwechsel beeinflusst. Forscher kartierten Protein-Itaconat-Wechselwirkungen und stellten fest, dass Itaconat mehrere Enzyme im Glykolyseweg direkt bindet und reguliert und so dessen Geschwindigkeit und Richtung beeinflusst. Diese Forschung erweitert unser Wissen über Stoffwechselkontrollmechanismen bei krankheitsbedingten Entzündungen und zeigt die Stärke von ABPP bei der Erforschung, wie kleine Moleküle Proteinfunktionen modulieren. Als führendes Unternehmen in der chemischen Proteomik bietet Corolus BioScience umfassende Lösungen, einschließlich Sondendesign, Probenverarbeitung, Hochdurchsatz-Screening und Datenanalyse, um Kunden bei der Aufdeckung ähnlicher Stoffwechsel-Regulationsmechanismen zu unterstützen.
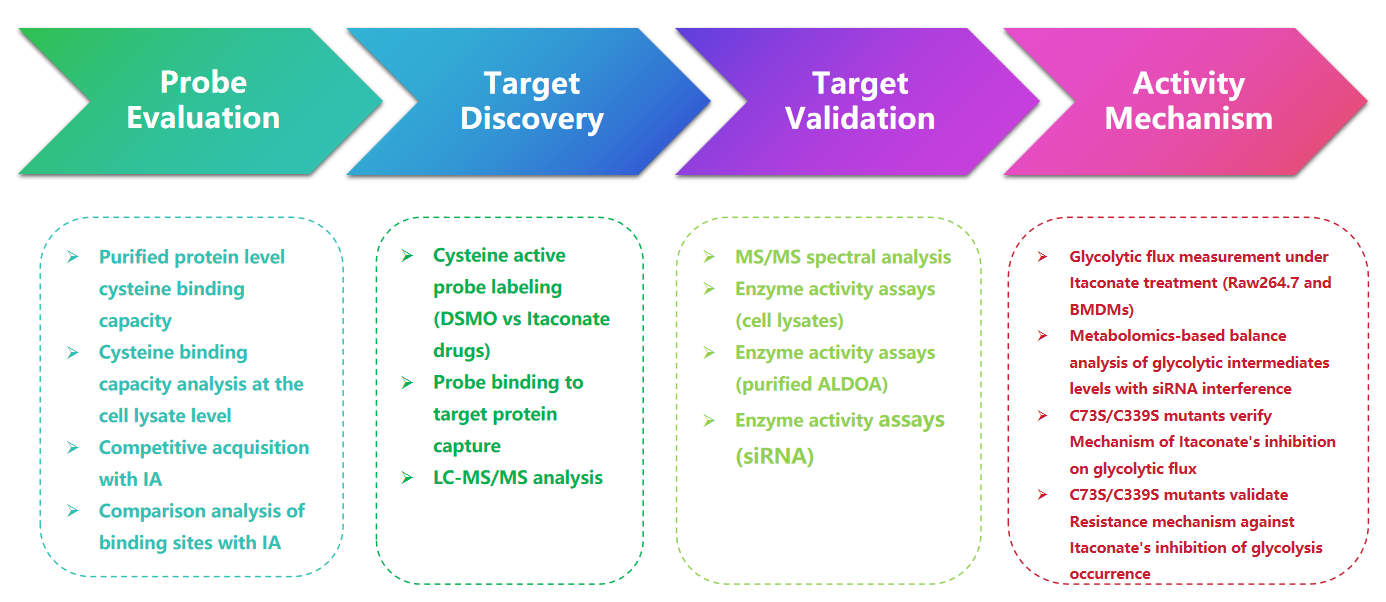
1. Nachweis von Itaconat-Modifikationen mit der 1-OH-Az-Sonde
In dieser Studie verwendeten die Autoren fortschrittliche Profilierungstechniken, um auf Itaconat gerichtete Cysteinreste zu untersuchen. Sie untersuchten zunächst die Sonde 1-OH-Az durch Gelelektrophorese und führten Konkurrenzexperimente mit IA-Alkin durch. Die massenspektrometrische Validierung bestätigte, dass 1-OH-Az Cysteinstellen selektiv markiert, wobei 87 % der neu identifizierten Proteine zuvor nicht als Liganden-bindende Proteine in DrugBank dokumentiert waren. Angesichts der vielfältigen Funktionen und Krankheitsrelevanz dieser Proteine kann die 1-OH-Az-Sonde verwendet werden, um aktive Cysteine als potenzielle Wirkstoffziele für neuartige Therapeutika zu identifizieren.
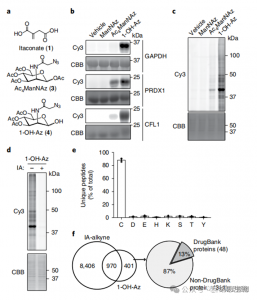
Abbildung 1: 1-OH-Az als effiziente und einzigartige Cystein-Analysesonde zum Nachweis von Itaconat-Modifikationen
2. Identifizierung von Itaconat-Modifikationsstellen mithilfe quantitativer Proteomics-Techniken
Die Forscher führten isoTOP-ABPP-Experimente durch, um durch Itaconat modifizierte Cysteinreste mithilfe der 1-OH-Az-Sonde zu quantifizieren. Nach der Vorbehandlung des Lysats wurden isotopenmarkierte Linker-unterstützte quantitative Proteomik eingesetzt, um die Auswirkungen unterschiedlicher Konzentrationen von Itaconat zu analysieren und seine spezifischen Ziele zu lokalisieren. Es wurden auch Vergleichsexperimente mit zwei Konzentrationen von IA-Alkin durchgeführt, die zwar eine breitere Aktivität und Abdeckung zeigten, aber nur 65 und 50 wirksame konkurrierende Stellen erkannten. Bemerkenswerterweise zeigte 1-OH-Az einen deutlich höheren Wettbewerbsvorteil gegenüber co-quantifizierten Cysteinen.
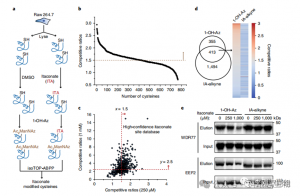
Abbildung 2: Chemische Proteomanalyse von Itaconat-modifizierten Cysteinen unter Verwendung von kompetitivem isoTOP-ABPP mit 1-OH-Az
3. Itaconat modifiziert und hemmt ein wichtiges glykolytisches Enzym
Die massenspektrometrische Analyse ergab, dass Itaconat drei wichtige glykolytische Enzyme verändert: ALDOA, GAPDH und LDHA. Die endogene Itaconatmodifikation an Cys73 und Cys339 von ALDOA wurde in LPS-stimulierten Raw264.7-Zellen bestätigt. Aufgrund ihrer Nähe spekulierten die Autoren, dass solche Modifikationen die Aldolaseaktivität beeinflussen könnten. Tatsächlich führte die Behandlung mit 1 mM Itaconat zu einer verringerten ALDOA-Enzymaktivität, ohne die Proteinexpression zu beeinträchtigen. Darüber hinaus zeigten isoTOP-ABPP-Analysen, dass Cys84 auf LDHA und Cys245 auf GAPDH ebenfalls Ziele für die Itaconat-Modifikation sind.

Abbildung 3: Itaconat kann die ALDOA-Funktion verändern und beeinträchtigen
4. Itaconat unterdrückt hauptsächlich die Glykolyse, indem es auf ALDOA abzielt
Um die regulatorische Rolle von ITAC bei der entzündlichen Makrophagen-Glykolyse zu beurteilen, überwachten die Autoren den Glukoseverbrauch und die Laktatproduktion in Raw264.7-Zellen vor und nach der LPS-Stimulation und zeigten, dass ITAC beides signifikant verringerte, was auf eine Unterdrückung der glykolytischen Funktion hinweist. Um die Wirkung von ITAC auf ALDOA und die anschließende Hemmung der Glykolyse zu validieren, haben sie endogenes ALDOA mithilfe von RNAi ausgeschaltet und entweder WT oder doppelt mutiertes (C73S/C339S) ALDOA in Raw264.7-Zellen überexprimiert. Wie erwartet führte der Abbau von ALDOA zu einem verringerten Glukoseverbrauch und einer geringeren Laktatproduktion, wodurch die Zellen unempfindlich gegenüber der ITAC-Behandlung wurden. Die Wiedereinführung von WT oder mutiertem ALDOA stellte die Stoffwechselniveaus in unbehandelten Zellen wieder her; Allerdings zeigten Zellen, die das mutierte ALDOA überexprimierten, im Vergleich zu WT eine geringere Empfindlichkeit gegenüber glykolytischer Hemmung. Enzymatische Tests für Aldolase-Aktivität im Einklang mit glykolytischen Zuständen.
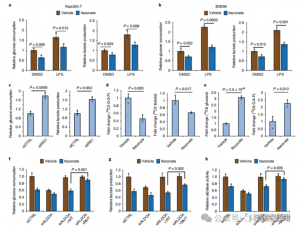
Abbildung 4: Itaconat verändert den glykolytischen Weg durch Modifizierung von ALDOA
5. Die Hemmung von ALDOA trägt zu entzündungshemmenden Reaktionen bei
Diese Ergebnisse zeigten, dass ITAC die Aktivität des glykolytischen Signalwegs unterdrückt, indem es die Cysteinreste Cys73 und Cys339 auf ALDOA modifiziert. Aus der bekannten entzündungshemmenden Wirkung von Dimethylfumarat über Cysteinmodifikation auf GAPDH und glykolytische Hemmung folgerten die Autoren außerdem, dass ITAC in ähnlicher Weise in die Glykolyse eingreifen und so eine entzündungshemmende Wirkung entfalten könnte. Durch den Abbau von ALDOA wurde die IL-1β-Sekretion bei LPS-Stimulation deutlich reduziert, was darauf hindeutet, dass es an der Regulierung von Entzündungen durch Glykolyse beteiligt ist. Die teilweise Umkehrung der entzündungshemmenden Wirkung des ALDOA-Knockdowns durch ergänztes Pyruvat deutete auf eine begrenzte Rolle von LDHA bei Entzündungsreaktionen hin.
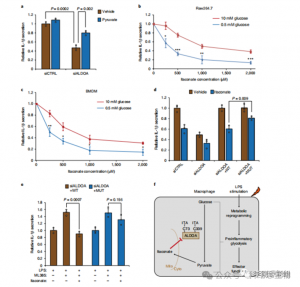
Abbildung 5: Die entzündungshemmende Wirkung von Itaconat wird durch seine Hemmung von ALDOA vermittelt, was zu einer Störung der Glykolyse führt
Zusammenfassend lässt sich sagen, dass dieser Artikel auf S-Glykosylierung basierende Cystein-Profiling-Technologien und ABPP-Methoden wirksam genutzt hat, um ein Netzwerk von Wechselwirkungen zwischen Itaconat und verwandten Proteinen aufzubauen. Es zeigt überzeugend, dass Itaconat als entscheidender Stoffwechselregulator fungiert, indem es Cysteinreste auf Proteinen gezielt modifiziert, um den glykolytischen Weg zu steuern. Diese Forschung klärt nicht nur den Wirkungsmechanismus von Itaconat als neuartigem Stoffwechselregulator auf, sondern liefert auch belastbare Beweise dafür, wie kleine Metaboliten mit Proteinen interagieren, um zentrale Stoffwechselwege zu modulieren.
Zu den weiteren Methoden zur Untersuchung der Wechselwirkungen zwischen niedermolekularen Metaboliten und Proteinen gehören neben ABPP unter anderem:
1. Affinitätsanreicherung (Pulldown)Techniken, bei denen die native Verbindung in eine biotinylierte Sonde umgewandelt wird, die mit Zelllysaten inkubiert, gefolgt von einer Streptavidin-vermittelten Anreicherung und Isolierung von Proteinzielen, die an die Biotinsonde binden.
2.Limitierte Proteolyse-Massenspektrometrie (LiP-MS)ist eine Technologie zur Zielerkennung, die auf Proteinaffinität basiert. Wenn bestimmte Liganden wie Medikamente oder kleine Moleküle an bestimmte Proteine binden, induzieren sie Konformationsänderungen oder sterische Hinderungen, die zu unterschiedlichen Spaltstellen im Vergleich zum ungebundenen Protein führen. Durch die Erkennung dieser Unterschiede mittels Massenspektrometrie kann diese Methode Arzneimittel-Protein-Wechselwirkungen innerhalb von Zellen identifizieren und die molekularen Ziele des Arzneimittels bestimmen.
3.Zellulärer thermischer Verschiebungstest (CETSA)wurde ursprünglich entwickelt, um die Erforschung von Wirkstoffzielen gegen Krebs zu unterstützen, und ist eine der ersten weit verbreiteten markierungsfreien Methoden zur Untersuchung der Wirkung von Wirkstoffzielen in intakten Zellen. CETSA basiert in erster Linie auf dem Prinzip, dass eine Verbindung bei der Bindung an ein Zielprotein ihre thermische Stabilität erhöht. Nach der Inkubation der Proben mit der Verbindung und entsprechenden Kontrollen bei verschiedenen Temperaturgradienten bleiben die an den Liganden gebundenen Proteine nach dem Erhitzen gefaltet und relativ stabil, während sich ungebundene Proteine aufgrund der Denaturierung entfalten und ausfallen. Die anschließende Analyse der Thermostabilität löslicher Proteine durch Immunblotting oder Massenspektrometrie-basierte Ansätze auf der Grundlage ihrer Schmelzkurven bestätigt die Wechselwirkung zwischen der Verbindung und intrazellulären Proteinen.
4. Affinitätschromatographiebeinhaltet die Konjugation des Zielmetaboliten an eine Festphasenmatrix, um Proteinkomplexe einzufangen, die mit ihm interagieren. Die eingefangenen Proteine werden dann mithilfe von Techniken wie der Massenspektrometrie identifiziert.
5.Oberflächenplasmonenresonanz (SPR)wird zur markierungsfreien Echtzeitmessung kinetischer Parameter im Zusammenhang mit den Wechselwirkungen zwischen kleinen Molekülen und Proteinen verwendet.
6. Proteinkristallographieerklärt die dreidimensionalen Strukturen von Proteinen, die mit Liganden kleiner Moleküle komplexiert sind, und bietet einen intuitiven Einblick in die Bindungsstellen und Wirkmechanismen. Durch die Lösung dieser Strukturen können Forscher direkt visualisieren, wie die kleinen Moleküle mit ihren Proteinzielen interagieren.

