Verwendung chemischer Proteomik zur Identifizierung des funktionellen Ziels SLC25A20 von Ingenolmebutat für aktinische Keratose
Diese Studie nutzt chemische Proteomik, um ein neues Ziel von Makromorolmethylbutylat (Ing-Meb) zu entdecken, einem Medikament zur Behandlung von solarer Keratose. Das Forschungsteam entwickelte und synthetisierte zunächst eine Ing-Meb-Photoaffinitätssonde namens Ing-Dayne, die bei UV-Lichteinwirkung kovalente Bindungen mit Zielproteinen bildet und so die Identifizierung potenzieller funktioneller Ziele erleichtert. Durch anschließende Validierung identifizierten die Autoren SLC25A20 als zentrales Ziel von Ing-Meb. SLC25A20 ist eine mitochondriale membrangebundene Carnitin-Acylcarnitin-Translokase, die am Fettsäurestoffwechsel beteiligt ist. Bemerkenswert ist, dass die hemmende Wirkung von Ing-Meb auf die SLC25A20-Funktion zu einer verstärkten Akkumulation von langkettigen Acylcarnitinen führt, was belegt, dass Ing-Meb seine therapeutischen Wirkungen durch Modulation des Fettsäureoxidationsweges hervorruft. Darüber hinaus befasst sich die Studie mit der Bedeutung struktureller Modifikationen bei Naturstoffuntersuchungen. Durch die Synthese der Ing-Dayne-Photoaffinitätssonde durch strukturelle Modifikation von Ing-Meb gelang es den Forschern, ein neues Ziel zu entdecken, das sich vom herkömmlichen Verständnis unterscheidet. Dies verbessert nicht nur das Verständnis von Ing-Meb und seiner Wirkungsweise, sondern unterstreicht auch die zentrale Rolle der Strukturmodifikation in der chemischen Proteomikforschung für die Aufklärung der Komplexität natürlicher Produkte. Solche Erkenntnisse treiben die Arzneimittelinnovation weiter voran und umfassen die Optimierung der Wirksamkeit bestehender Arzneimittel, die Entwicklung neuartiger Therapien für bestimmte Einheiten und die Aufklärung der Mechanismen von Arzneimittelnebenwirkungen.
Forschungsroute
Experimenteller Prozess
1. Die Entwicklung der synthetischen Ing-Dayne-Photoaffinitätssonde enthüllt den Mechanismus, der der Bindung des Medikaments gegen aktinische Keratose Ing-Meb an sein Zielprotein zugrunde liegt.
In dieser Studie wurde die Ing-Affinitätssonde Ing-Dayne eingesetzt, die vom therapeutischen Medikament gegen aktinische Keratose Ing-Meb abgeleitet ist (siehe Abbildung 1). Durch die gemeinsame Kultivierung dieses Sondenmoleküls mit bestimmten Zellen und die anschließende Bestrahlung mit UV-Licht bildete die doppelte Acridinstruktur innerhalb der Sonde stabile kovalente Bindungen mit intrazellulären Proteinen. Bei der Zelllyse erleichterte eine chemische Click-Reaktion die Bindung der Reportergruppe Azid-Tetramethylrhodamin an das Zielprotein (wie in Abbildung 2 dargestellt). Die anschließende SDS-PAGE-Analyse (dargestellt in Abbildung 3) ergab, dass Ing-Meb einen signifikanten kompetitiven Bindungseffekt auf die Sonde aufwies, wohingegen Ingenol, das eine ähnliche Struktur besaß, keine kompetitive Hemmung zeigte.
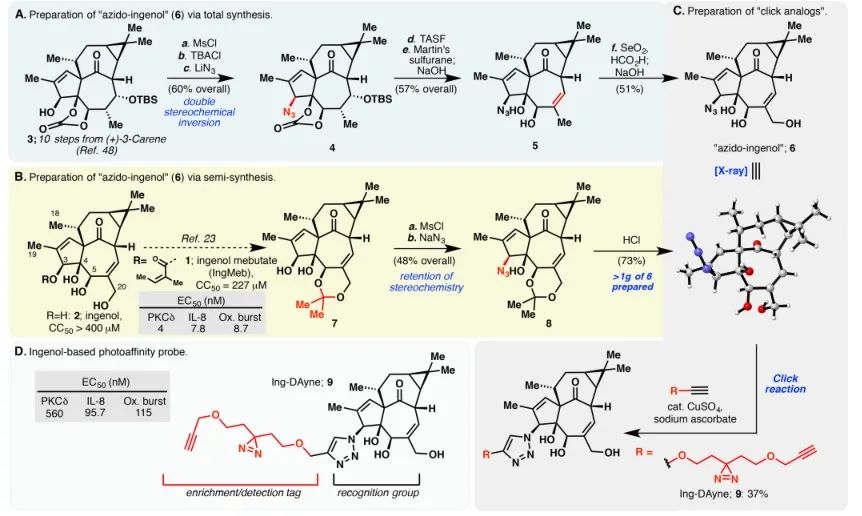
Abbildung 1: Veranschaulicht die beiden Synthesewege, die für die Synthese von Ing-Dayne verwendet wurden.
2. Die neuartige Sonde 11b hat 44 entzündungsbedingte Zielproteine von BBR in THP-1-Zellen identifiziert und EIF2AK2, eEF1A1, PRDX3 und VPS4B als direkte Ziele mit spezifischen Wechselwirkungen mit BBR identifiziert.
In einer Reihe von Experimenten setzten die Autoren die neuartige Sonde 11b erfolgreich ein, um potenzielle Zielproteine in THP-1-Zellen zu markieren und zu reinigen. Anschließend identifizierten sie mithilfe einer LC-MS/MS-Analyse 44 entzündungsassoziierte Proteine im Molekulargewichtsbereich von 20 bis 80 kDa, von denen sechs möglicherweise eine entscheidende Rolle bei der entzündungshemmenden Wirkung von BBR spielten. In weiteren Untersuchungen wurde bestätigt, dass EIF2AK2, eEF1A1, PRDX3 und VPS4B direkte Ziele von BBR sind und unter hohen Konzentrationen der BBR-Behandlung kompetitive Hemmwirkungen zeigen. Dieser Befund offenbarte die wahrscheinliche Existenz spezifischer Wechselwirkungen zwischen diesen Proteinen und BBR und lieferte so neue Einblicke in ihre Interaktion mit dem Medikament während seiner entzündungshemmenden Prozesse.
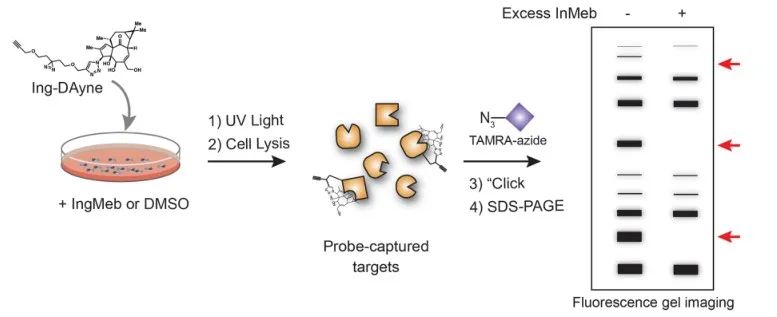
Abbildung 2: Gelbasierter Validierungsprozess des Ing-Dayne-Ziels.
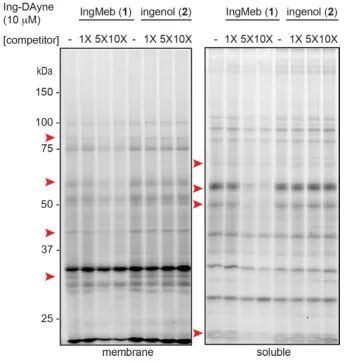
Abbildung 3: Kompetitive Hemmung von Ing-Meb und Ingenol auf dem Sondenmolekül Ing-Dayne.
3. Das SILAC-Screening in Kombination mit der Western-Blot-Validierung identifizierte SLC25A20 als primäres Ziel des Ingenol-Klasse-Medikaments Ing-Meb.
Die Autoren untersuchten zunächst 28 potenzielle Zielproteine mithilfe der SILAC-Technologie (Stable Isotope Labeling by Amino Acids in Cell Culture) (Abbildung 4). Anschließend stellten die Forscher durch weitere Screening- und Western-Blot-Validierungsexperimente (Abbildung 5) fest, dass Ing-Meb unter diesen Zielkandidaten die stärkste Hemmwirkung auf SLC25A20 aufwies, was stark darauf hindeutet, dass SLC25A20 eines der wichtigsten funktionellen Ziele von Ing-Meb ist.
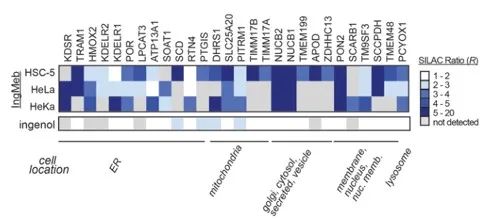
Abbildung 4: Die 28 potenziellen Ziele, die beim ersten Screening ermittelt wurden.
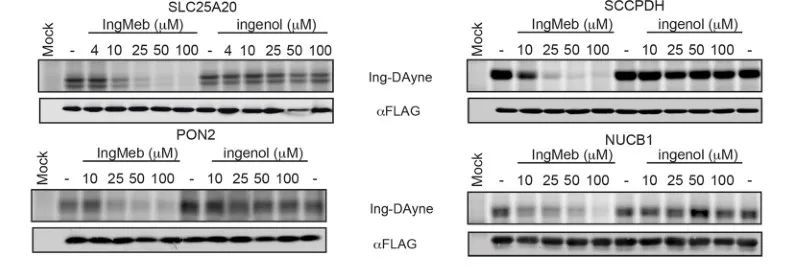
Abbildung 5: Western-Blot-Experimente von vier potenziellen Zielproteinen.
4. Ing-Meb reguliert den Fettsäureoxidationsweg durch Hemmung von SLC25A20, einem mitochondrialen Membranprotein, das auch als Botulinum-Alkalipoyltransferase bekannt ist, und enthüllt so sein Ziel als Medikament gegen aktinische Keratose.
Die Autoren untersuchten SLC25A20, auch bekannt als Botulinum-Alkali-Lipoyltransferase oder CACT, ein multimodales integrales Membranprotein, das in der Mitochondrienmembran lokalisiert ist. Seine Hauptfunktion besteht im Transport langkettiger Acylcarnitine in die Mitochondrien und erleichtert deren Austausch mit freiem Carnitin. Diese transportierten Acylcarnitine werden anschließend durch Carnitin-Palmitoyltransferase-2 (CPT-2) in Fett-AcylCoA umgewandelt und dienen so als Vorläufer für die Fettsäure-β-Oxidation. Experimentelle Ergebnisse zeigten einen signifikanten Anstieg des zellulären Gehalts an langkettigem Acylcarnitin mit steigenden Konzentrationen des Medikaments gegen aktinische Keratose Ing-Meb (dargestellt in Abbildung 6). Diese Beobachtung unterstützt stark die hemmende Wirkung von Ing-Meb auf SLC25A20 und bestätigt damit, dass SLC25A20 eines der Hauptziele ist, das die Wirkung von Ing-Meb vermittelt.
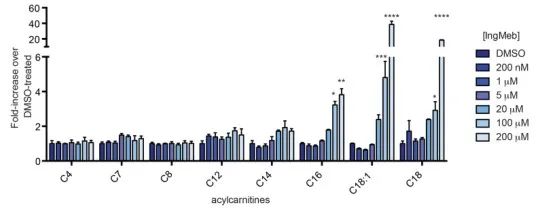
Abbildung 6: Wirkung von Ing-Meb auf langkettige Acylcarnitine
5. Indirekte Validierung der zytotoxischen Wirkung von Ing-Meb über die SLC25A20-Expression: Aufdeckung seiner Zielfunktion bei der Regulierung der Arzneimittelaktivität.
Die Forscher versuchten, die Hemmung von SLC25A20 in HeLa-Zellen direkt mit den möglichen zytotoxischen Wirkungen von Ing-Meb in Verbindung zu bringen. Die Ergebnisse zeigten, dass die Überexpression von SLC25A20 zwar die halbe Hemmkonzentration von Ing-Meb in diesen Zellen nicht veränderte, es jedoch bemerkenswert ist, dass eine erhöhte SLC25A20-Expression den Einfluss von Ing-Meb auf die Akkumulation von langkettigem Acylcarnitin deutlich abschwächte (dargestellt in Abbildung 7). . Dieses Ergebnis untermauert die Hypothese weiter, dass SLC25A20 als zentrales funktionelles Ziel für die Arzneimittelaktivität von Ing-Meb dient.
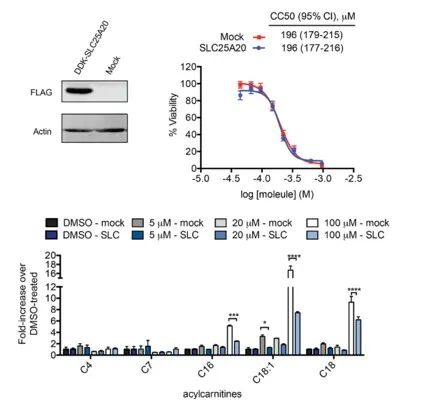
Abbildung 7: Auswirkung der Expression oder Nichtexpression von SLC25A20 auf CC50 und Acylcarnitin.
Diese Studie enthüllt nicht nur die neuen Ziele von Ing-Meb, sondern bietet auch eine neue theoretische Grundlage und strategische Ausrichtung für die Zielentdeckung strukturell komplexer Naturstoffe. Referenz:

