[Durchbruch mit hoher Punktzahl] Weiterentwicklung der entzündungshemmenden Regulierung von SLC15A4 mit dem neuartigen Inhibitor AJ 2-30: Ein chemischer Proteomics-Ansatz (IF 14.8)
Dieser Artikel nutzt chemische Proteomik, um eine Reihe neuartiger Inhibitoren zu entwickeln und zu testen, die auf SLC15A4 abzielen, ein entscheidendes entzündungsförderndes Transmembranprotein, das in Antigen-präsentierenden Zellen stark exprimiert wird. Das anfängliche Targeting potenzieller Inhibitoren nutzte die Strategie der Sondenbibliothek mit vollständig funktionalisierten Fragmenten (FFF) und identifizierte FFF-21 unter zahlreichen Sonden als wirksamen Inhibitor der IFN-α-Produktion. Die anschließende Strukturoptimierung führte zur Entwicklung der Verbindung AJ 2-30, die nicht nur eine hervorragende Hemmung zeigte, sondern auch SLC15A4 als primäre Zielmodifikation nach der Photovernetzung bestätigte. Weitere Untersuchungen ergaben, dass AJ 2-30 starke entzündungshemmende Wirkungen ausübte, indem es die Stabilität von SLC15A4 verringerte, dessen Abbau über den lysosomalen Weg induzierte und die Aktivierung von TLR 7-9 und NOD wirksam hemmte. Diese Studie ist nicht nur ein erfolgreicher Pionier für SLC15A4-Inhibitoren mit signifikanter entzündungshemmender Wirkung, sondern ebnet auch den Weg für die Entwicklung neuartiger entzündungshemmender Medikamente.

Forschungsroute
Experimenteller Prozess
1. Strategie der Sondenbibliothek mit vollständig funktionalisierten Fragmenten (FFF) zum Screening nach SLC15A4-Inhibitoren.
Die Autoren begannen ihre Studie mit dem Screening von SLC15A4-Inhibitoren mithilfe einer vollständig funktionalisierten Fragment-Sondenbibliothek (FFF). Diese FFF besteht aus zwei Komponenten: einer molekularen Erkennungsgruppe, die Tablettenfragmente enthält, die auf SLC15A4 abzielen, und einer weiteren photovernetzten, angereicherten Gruppe mit doppelten Acrimidin- und Alkingruppen zur Visualisierung von SLC15A4. Mithilfe eines chemischen Proteomik-Workflows bestätigten die Autoren die Bindung dieser FFF-Sondenbibliothek an SLC15A4 in Zellen und bewerteten, ob die FFF-Sonde die IFN-α-Spiegel in TLR 9-stimulierten Zellen abschwächen kann. Die Ergebnisse zeigten, dass von allen FFF-Sonden, die an SLC15A4 binden, FFF-21 die höchste Fähigkeit zur Hemmung der IFN-α-Spiegel aufwies, während sein markierungsfreies Analogon FFF-21c ebenfalls ähnliche Hemmwirkungen zeigte.
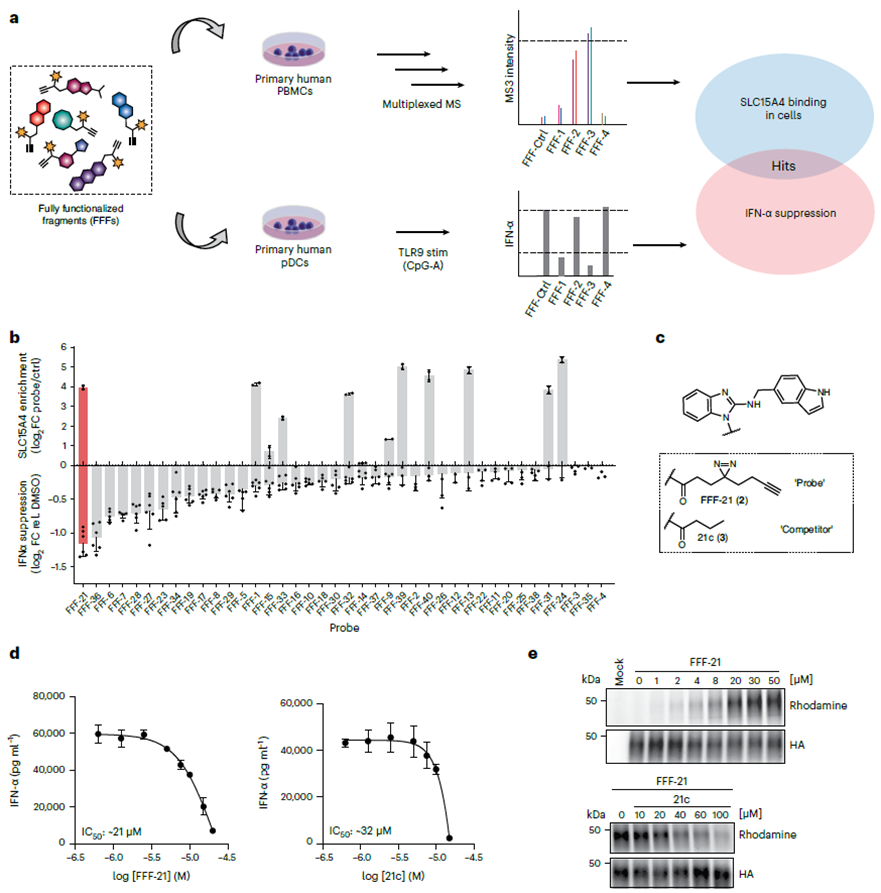
2. Photovernetzende Modifikation der SLC15A4-Inhibitoren.
Nach der anfänglichen Auswahl der Verbindung FFF-21c begannen die Autoren mit der Optimierung ihrer Struktur. Durch die Synthese mehrerer Analoga von FFF-21c identifizierten sie AJ 2-30 als den wirksamsten Inhibitor. Mithilfe von Photovernetzungstechniken bestätigten sie die Wechselwirkung mit dem Ziel. Mithilfe der direkten Markierungsmethode und der indirekten Konkurrenzmethode von ABPP sowie der Analyse der zellulären thermischen Verschiebung (CETSA) identifizierten die Autoren anschließend SLC15A4 endgültig als primäres Ziel von AJ 2-30.
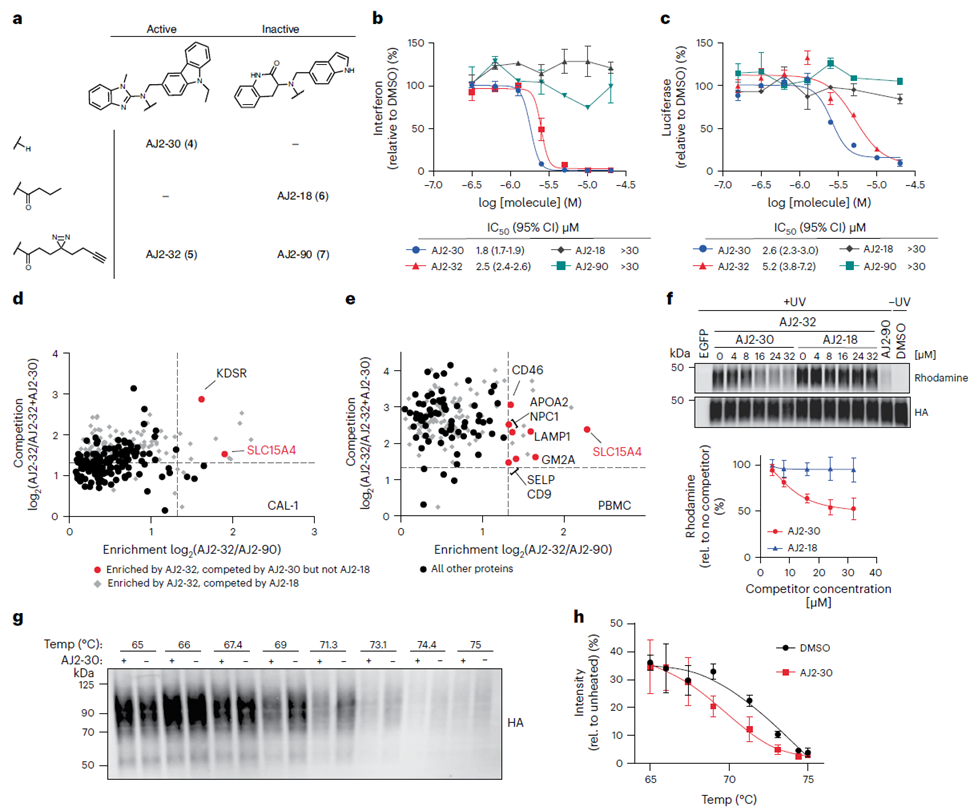
3. Der entzündungshemmende Mechanismus zeigt, dass AJ 2-30 die Stabilität von SLC15A4 stört.
Nach der Bestätigung der Bindung von AJ 2-30 an SLC15A4 und seiner hemmenden Wirkung führten die Autoren eine Reihe biochemischer Experimente durch, um den entzündungshemmenden Mechanismus von AJ 2-30 aufzuklären. Die Ergebnisse zeigten, dass AJ 2-30 den Lysosomen-vermittelten Abbau von SLC15A4 durch Destabilisierung des Proteins induziert und dadurch die Aktivierung von TLR 7-9 und NOD in Immunzellen in SLC15A4-abhängiger Weise hemmt. Dies unterstreicht das Potenzial von AJ 2-30 bei der Behandlung von entzündlichen und Autoimmunerkrankungen.
Zusammenfassend lässt sich sagen, dass diese Studie geschickt Techniken der chemischen Proteomik nutzt, um AJ 2-30 zu identifizieren, einen wirksamen SLC15A4-Inhibitor mit bemerkenswerter entzündungshemmender Aktivität. Diese Verbindung zeigt in Tiermodellen eine signifikante Wirksamkeit, indem sie gezielt auf die Stabilität von SLC15A4 und seine Rolle bei der Antigenpräsentation und den Entzündungssignalwegen abzielt. Dieser entscheidende Fortschritt erweitert nicht nur unser Verständnis der entzündungshemmenden Therapieziele, sondern legt auch eine solide Grundlage für die zukünftige Entwicklung neuartiger Therapeutika für eine Vielzahl von Entzündungs- und Autoimmunerkrankungen. Mit weiterer Forschung und klinischer Validierung sind diese neuen SLC15A4-Inhibitoren in der Lage, einer Vielzahl von Patienten präzisere und wirksamere Behandlungsmöglichkeiten zu bieten und damit einen tiefgreifenden Einfluss auf die globale Gesundheit zu haben.

