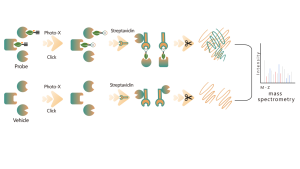Produkte
Omics-Analyse posttranslationaler Cystein-Modifikationen
Cystein spielt mit seiner bemerkenswerten Reaktivität eine zentrale Rolle in der Proteinstruktur und -funktion. Als nukleophiles Reagens, redoxkatalytisches Zentrum, Metallionenligand und Schlüsselstelle für Konformationsänderungen ist es umfassend an der Proteinaktivität und den Regulierungsmechanismen beteiligt und hat einen tiefgreifenden Einfluss darauf. Es ist erwähnenswert, dass Cysteinreste anfällig für verschiedene Arten von posttranslationalen Modifikationen (PTMs) sind, die nicht nur die funktionellen Eigenschaften von Proteinen fein abstimmen, sondern auch zu funktionellen Beeinträchtigungen führen können. Angesichts des engen Zusammenhangs solcher Modifikationen mit zahlreichen schweren Erkrankungen des Menschen ist die qualitative und quantitative Analyse von Cystein-PTMs in Proteinen von größter Bedeutung. Dies ist von unverzichtbarer Bedeutung für ein tiefgreifendes Verständnis der biologischen Funktionen relevanter Proteine und ihrer Wirkmechanismen bei Gesundheits- und Krankheitszuständen.
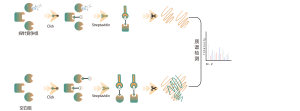
Chomix verfügt über umfangreiche Erfahrung in der Identifizierung von Cysteinmodifikationen, wie z. B. der Cysteinpersulfidierung. Durch den innovativen Einsatz universeller Cysteinsonden, die auf dem pKa-Unterschied zwischen -SH und -SSH basieren, passen wir den pH-Wert an, um Hintergrundstörungen durch -SH zu reduzieren, sodass die Sonden vorwiegend -SSH markieren und so Sulfenylierungsstellen effektiv identifizieren können.
Chomix verfügt über eine fortschrittliche Massenspektrometrietechnologie, die in der Lage ist, verschiedene Arten von posttranslationalen Proteinmodifikationen und ihre spezifischen Standorte direkt und genau aufzulösen. Durch die clevere Integration von Trenn- und Anreicherungstechniken mit Isotopenmarkierung und anderen fortschrittlichen Methoden ermöglichen wir eine groß angelegte qualitative und quantitative Analyse verschiedener Modifikationen mit hohem Durchsatz und bieten solide technische Unterstützung für die eingehende Forschung zu posttranslationalen Proteinmodifikationen.

Unsere Vorteile
1. Fachkompetenz: Mit umfangreicher Erfahrung und Veröffentlichungen in führenden Fachzeitschriften bieten wir maßgeschneiderte Dienstleistungen für optimale Ergebnisse.
2. Strenges Qualitätsmanagement: Unsere ausgereiften Qualitätssysteme entsprechen den ISO9001-Standards und gewährleisten zuverlässige Berichte.
3. Umfassender Service: Vom Sondendesign bis zur bioinformatischen Analyse bieten wir eine umfassende Beratung bis zur Lieferung mit zeitnahen Fortschrittsaktualisierungen.
4. Fortschrittliche Ausrüstung: Ausgestattet mit modernsten Massenspektrometern wie Thermo Fisher Orbitrap Exploris 480 und Bruker timsTOF unterstützen wir bahnbrechende Forschung.
Unser Service
| Projekt | Omics-Analyse posttranslationaler Cystein-Modifikationen |
| Probe | Reines Protein, Zelllysat, lebende Zellen, erkranktes Gewebe, Blut, Bakterien, Pflanzengewebe |
| Hardwareplattform | Berührungsloser Ultraschall-Zellpulverisierer, ChemiDoc MP-Bildgebungssystem, Orbitrap Fusion Lumos Tribrid/Orbitrap Exploris 480/Q Exactive HF-X/timsTOF Pro 2 Massenspektrometer |
| Projektdauer | 4-8 Wochen |
| Leistungen | Projektbericht (einschließlich experimenteller Verfahren, Datenanalysediagramme, Ergebnisse der bioinformatischen Analyse) |
| Preis | Klicken Sie hier, um sich zu beraten |
Fallstudie
Unter Thiolierung versteht man die durch Schwefelwasserstoff (H2S) vermittelte Kopplung einer Thiolgruppe (-SSH) an Cysteinreste in Proteinen. Um diesen Prozess weiter zu untersuchen, können ganze Proteome aus Zell- oder Gewebeproben extrahiert und mithilfe einer chemischen Sondenmethode (Cystein-spezifische Sonde) markiert werden. Im Gegensatz zur Thiol-Interferenz ermöglicht diese Methode eine effektive Markierung von Thiolgruppen durch präzise Einstellung des pH-Werts. Mithilfe hochauflösender Massenspektrometrie können Forscher anschließend Thiolierungsstellen genau identifizieren und so die wichtige Rolle dieser posttranslationalen Modifikation in vivo weiter verdeutlichen.
Mithilfe von HeLa-Zellmodellen wurde zunächst das gesamte Proteom extrahiert. Anschließend ermöglichte die Modellierung mit NaHS und die pH-Anpassung die genaue Markierung von Thiolgruppen durch eine universelle Cysteinsonde. Durch eine Reihe von Schritten, einschließlich Anreicherung, enzymatischer Verdauung und massenspektrometrischem Nachweis, wurden 180 Peptide mit -SSH-Modifikationen sowie 120 verwandte Proteine, einschließlich der gemeldeten Thiolierungsstellen GAPDH_C152 und C247, identifiziert.

Hier sind die MS/MS-Spektren von Peptiden mit -SSH-Modifikationen: