[Nationale Schlüsselprojektfinanzierung] Entschlüsselung metallbindender Proteine: METAL-TPP-Durchbrüche und Innovationen in der Arzneimittelentdeckung
Metallbindende Proteine sind entscheidende Komponenten, die stabile Komplexe mit Metallionen bilden und verschiedene lebenswichtige Funktionen in lebenden Organismen erfüllen, darunter Zellsignalisierung, Katalyse biochemischer Reaktionen und Aufrechterhaltung der Metallionenhomöostase. Ihre Fehlregulation wird mit Krankheiten wie Krebs, neurologischen Störungen und Stoffwechselerkrankungen in Verbindung gebracht. Das Verständnis ihrer Rolle bei der Pathogenese von Krankheiten ist für Diagnose und Behandlung von entscheidender Bedeutung. Darüber hinaus sind metallbindende Proteine wichtige Ziele in der Arzneimittelentwicklung, da viele Arzneimittel mit ihnen interagieren, um therapeutische Wirkungen auszuüben. In dieser Studie stellten die Forscher METAL-TPP vor, eine hochmoderne Methode der chemischen Proteomik. Durch die Kombination der quantitativen Proteomanalyse (TPP) mit Thermostabilität und der Identifizierung metallbindender Proteine ermöglicht METAL-TPP einen effizienten und genauen Nachweis metallbindender Proteine. Insbesondere reguliert es die Thermostabilität von Proteinen mithilfe einer Reihe von Metallchelatbildnern und erleichtert so die präzise Identifizierung in reinen Proteinen und Zelllysaten. Dieser innovative Ansatz bietet neue Einblicke in die Funktion und Mechanismen metallbindender Proteine und unterstützt die biologische Forschung, das Verständnis von Krankheiten und die Arzneimittelentwicklung. Keloxi Biology bietet fortschrittliche ABPPs, TPP und andere technische Dienstleistungen in der pharmazeutischen Forschung und Entwicklung und unterstützt Forscher bei der Erforschung von Arzneimittelmechanismen und der Weiterentwicklung neuer Arzneimittelentwicklungsprozesse.

Experimenteller Prozess
1. Siebzehn potenzielle metallbindende Proteine wurden mithilfe von METAL-TPP identifiziert.
Zunächst untersuchten die Forscher die Wirksamkeit der Breitspektrum-Metallchelatbildung mit EDTA an reinen Proteinen und Zelllysaten. Sie beobachteten, dass METAL-TPP effektiv Verringerungen der thermischen Stabilität metallbindender Proteine detektierte. Anschließend wurde eine systematische Analyse menschlicher Proteine mithilfe von METAL-TPP durchgeführt und dabei 125 Proteine identifiziert, die eine verminderte Thermostabilität aufwiesen. Davon waren 102 bereits bekannte metallbindende Proteine. Darüber hinaus wurden 17 potenzielle metallbindende Proteine ohne vorherige funktionelle Annotation entdeckt, was neue Einblicke in die Rolle metallbindender Proteine bietet.
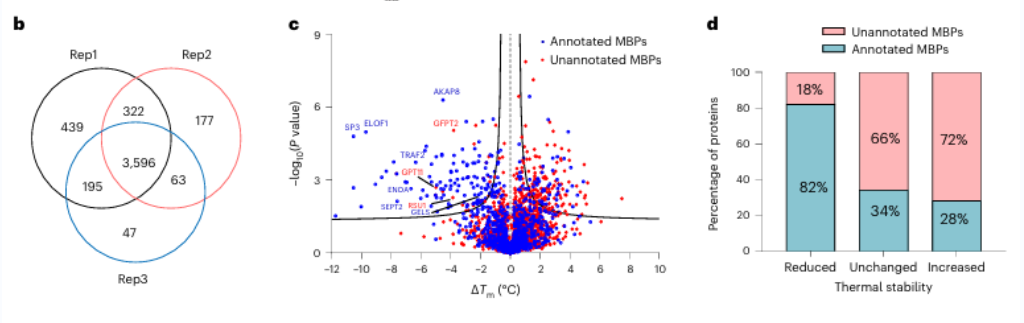
2. Die Wirkung von Zinkionen auf das potenziell metallbindende Protein GFPT2.
Unter diesen 17 potenziellen metallbindenden Proteinen entschieden sich die Forscher für eine eingehende biochemische Validierung des Proteins GFPT2. GFPT1/2 dient als erstes geschwindigkeitsbestimmendes Enzym im Hexose-Biosyntheseweg und unterstützt die Bildung einer Substanz namens UDP-GlcNAc. Forscher bestätigten auf zellulärer Ebene, dass Zinkionen mit GFPT2 interagieren und dessen Aktivität hemmen. Darüber hinaus beobachteten sie, dass die Anwesenheit von Zinkionen zu einer signifikanten Verringerung der UDP-GlcNAc-Spiegel führt, was darauf hindeutet, dass Zinkionen den Hexose-Biosyntheseweg regulieren, indem sie die Aktivität von GFPT2 hemmen. Interessanterweise zeigen Zinkionen eine unterschiedliche Selektivität bei der Hemmung der Aktivitäten von GFPT2 und GFPT1, was auf das Vorhandensein eines neuartigen Regulierungsmechanismus schließen lässt.
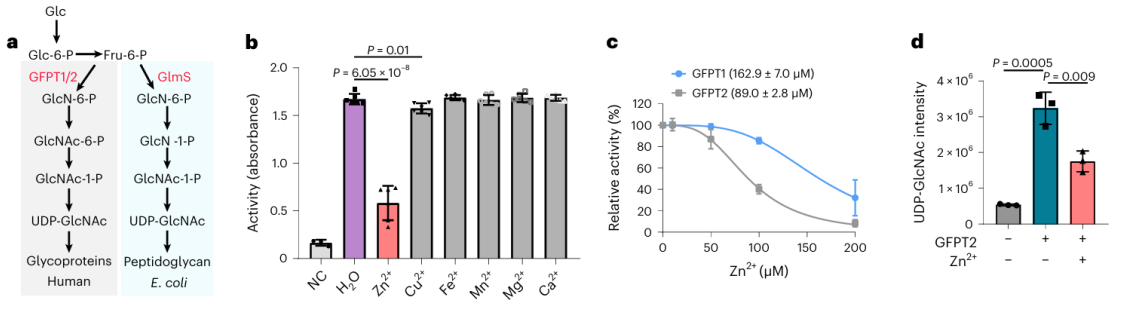
3. Entschlüsselung des molekularen Mechanismus von Zinkionen auf die Aktivität des GFPT2- und GLMS-Enzyms.
Die Forscher isolierten das Homolog des GFPT2-Proteins aus E. coli und führten eine Reihe biochemischer Experimente und Kristallstrukturanalysen durch. Die Ergebnisse zeigten, dass das GLMS-Protein die Fähigkeit besitzt, Zinkionen zu binden, und dass diese Bindung insbesondere in der Nähe der Substratbindungsregion stattfindet. Dies deutet auf ein mögliches Szenario hin, in dem Zinkionen um die Bindung am aktiven Zentrum von GLMS und GFPT2 konkurrieren oder die Aktivität beider Enzyme behindern könnten, indem sie Koordinationsbindungen mit ihren aktiven Zentren bilden.

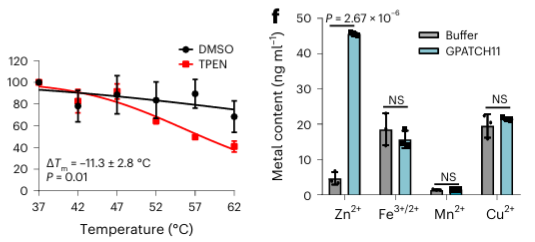
4.Der Metallchelatbildner TPEN kann Zinkionen-bindende Proteine spezifisch erkennen.
Schließlich erweiterten die Forscher die Fähigkeit von METAL-TPP, metallbindende Proteine in menschlichen Proteinen mithilfe des Metallchelators TPEN zu identifizieren. Experimentelle Ergebnisse zeigten, dass von den 150 Proteinen mit verringerter thermischer Stabilität 110 (73 %) bekannte metallbindende Proteine waren, was darauf hindeutet, dass TPEN, wie EDTA, metallbindende Proteine spezifisch erkennen kann. Unter diesen waren 95 (86 %) der bekannten metallbindenden Proteine Zinkionen-bindende Proteine, während nur 41 % der Proteine mit durch EDTA verursachter verringerter thermischer Stabilität Zinkionen-bindende Proteine waren, was darauf hindeutet, dass TPEN die Identifizierung von Zinkionen bevorzugt -bindende Proteine.
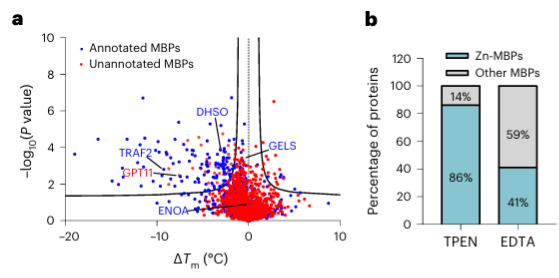
Unter den 40 identifizierten potenziellen metallbindenden Proteinen wählten die Autoren ein Zielprotein, GPATCH11, für die vorläufige biochemische Validierung aus und stellten fest, dass es sich bei diesem Protein um ein Zinkionen-bindendes Protein handelt.
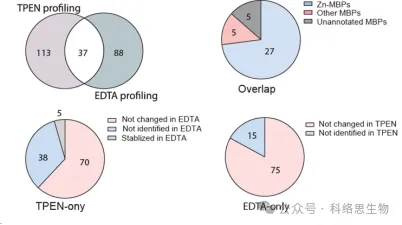
5. Vergleich der Erkennungsfähigkeit zweier Metallchelatoren in METAL-TPP.
Die Forscher verglichen auch die Fähigkeit zweier Metallchelatoren, TPEN und EDTA, Proteine mit verringerter thermischer Stabilität in METAL-TPP-Proteomikdaten zu identifizieren. Sie fanden heraus, dass von den 37 Proteinen, die von beiden Chelatoren identifiziert wurden, 27 bekanntermaßen Zink binden, 5 andere Metalle binden und 5 zuvor nicht als metallbindende Proteine identifiziert wurden. Für Proteine, deren thermische Stabilität unter einem Chelator abnahm und unter dem anderen unverändert blieb oder zunahm, schlugen die Forscher zwei mögliche Gründe für den Unterschied im Identifizierungsbereich durch METAL-TPP vor. Erstens kann jeder Chelator in einigen Proteinen als Bindungsligand fungieren, sie stabiler machen und der destabilisierenden Wirkung entgegenwirken, die durch die Metallbindung verursacht wird. Zweitens weisen die beiden Chelatoren aufgrund der unterschiedlichen Molekülstrukturen auch eine stark unterschiedliche Löslichkeit in Wasser auf. Daher können zukünftige METAL-TPP-Studien mit anderen Chelatoren mit einzigartigen Molekülstrukturen durchgeführt werden, um den Umfang des Metalloproteoms umfassender zu untersuchen.
Insgesamt hat diese Studie eine neuartige Methode, METAL-TPP, eingeführt, die als wirksames Werkzeug für die Durchführung von Untersuchungen zur Metallbindungsproteomik dient. Durch diesen Ansatz identifizierten Forscher systematisch metallbindende Proteine und klärten ihre Rolle bei biologischen Funktionen und Pathogenese auf. Dieses Unterfangen schafft nicht nur wichtige Datenbanken, sondern liefert auch wertvolle Erkenntnisse zum Verständnis der biochemischen Funktionen und des Arzneimittelentwicklungspotenzials metallbindender Proteine und fördert so die weitere Forschung in verwandten Bereichen.

