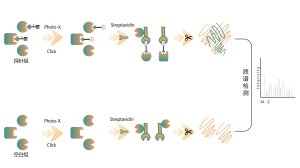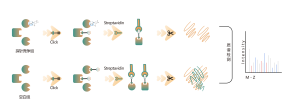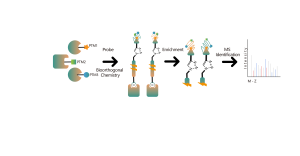Produkte
Identifizierung nichtkovalenter Bindungstaschen für kleine Moleküle in Zellen
Technische Merkmale der Plattform
Für die Arzneimittelforschung und -entwicklung ist es von entscheidender Bedeutung, den Bindungsmodus zwischen niedermolekularen Arzneimitteln und ihren Proteinzielen zu bestimmen. Eine umfassende Analyse dieser Wechselwirkungen sowohl auf struktureller als auch auf physikalisch-chemischer Ebene könnte unser Verständnis der Proteinfunktionen erheblich vertiefen und die Entwicklung und Optimierung von Arzneimitteln erleichtern. Strukturbiologische Techniken, einschließlich Röntgenstrahlen, Kryo-Elektronenmikroskopie (Kryo-EM), Kernspinresonanz (NMR) usw., werden häufig zur Bestimmung von Arzneimittelbindungsmodi eingesetzt. Die hochauflösenden Strukturen von Protein-Wirkstoff-Komplexen könnten bei der Optimierung von Arzneimittelstrukturen im Frühstadium von großem Nutzen sein. Allerdings stellt die Analyse der Proteinstruktur die biowissenschaftliche Forschung immer wieder vor Herausforderungen, insbesondere bei Membranproteinzielen wie G-Protein-gekoppelten Rezeptoren (GPCRs) und Ionenkanalproteinen. Bei Prozessen wie der Proteinreinigung, dem Screening auf die Kristallisation von Protein-Wirkstoff-Komplexen sowie der Datenerfassung und -verarbeitung sind häufig viel Zeit und Ressourcen erforderlich.
Ein idealer Ansatz besteht darin, Protein-Wirkstoff-Interaktionsmodi innerhalb lebender Zellen zu identifizieren. Dieser Ansatz vermeidet nicht nur hohe Kosten im Zusammenhang mit Strukturstudien, sondern eliminiert auch mögliche falsch positive Ergebnisse, die durch künstliche Bedingungen wie Puffer mit hohem Salzgehalt oder gesättigte Arzneimittel entstehen.

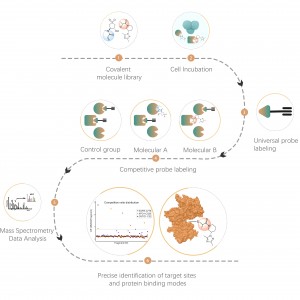
Arbeitsablauf

ChomiX verwendet chemische Photoaffinitätssonden, die von nichtkovalenten niedermolekularen Arzneimitteln abgeleitet sind, und ermöglicht so das Einfangen markierter Peptide, die sich in Bindungstaschen lebender Zellen befinden, und die anschließende Identifizierung durch Massenspektrometrie. Sobald Peptidsequenzen und markierte Stellen bestimmt sind, könnte der genaue Bindungsmodus mit Hilfe des molekularen Dockings schnell ermittelt werden.
Technische Vorteile

Fallstudie
Projektziel
Das mutmaßliche Ziel von Medikament B ist ein Transmembranprotein mit mehreren berichteten Medikamentenbindungstaschen. Strukturbiologische Methoden wie Röntgen und Kryo-EM scheiterten. Mithilfe der chemoproteomischen Strategie wird versucht, den Bindungsmodus in lebenden Zellen zu erreichen.
Experimentelle Methode
Die Photoaffinitätssonde B, die die photovernetzenden und bioorthogonalen Einheiten enthält, wurde entworfen und synthetisiert. Der Zieleingriff von Medikament B wurde zunächst bestätigt und das markierte Peptid in der Bindungstasche wurde mittels MS sequenziert.
Datenvisualisierung

Immunblot- und MS-basierte chemoproteomische Daten zeigten, dass der Arzneimittelkandidat effektiv um das sondenmarkierte Signal konkurrieren kann, was auf eine direkte Bindung des Arzneimittelkandidaten an das Zielprotein in lebenden Zellen hinweist.

MS/MS-Spektrum für Arzneimittelmodifikationspeptid: CLPFIIGCNPTILH*VHELYIR

Wirkstoffbindungsmodus basierend auf MS-basierten chemoproteomischen Daten und molekularem Docking