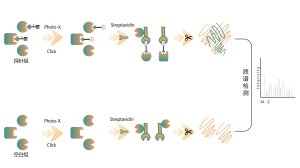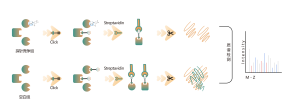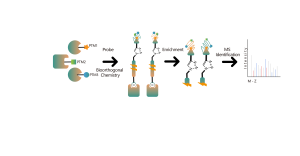Produkte
Analyse posttranslationaler Proteinmodifikationen (PTMs) basierend auf chemischen Sonden
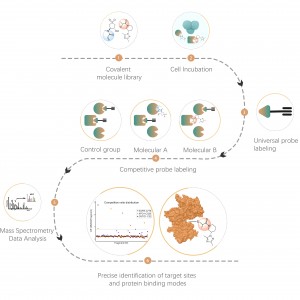
Zusätzlich zu den herkömmlichen Strategien zur Antikörperanreicherung wurden zunehmend chemische, enzymatische und metabolische Markierungstechniken zur Anreicherung und Identifizierung posttranslationaler Modifikationen (PTM) in Proteinen eingesetzt. Das zugrunde liegende Prinzip besteht darin, mithilfe einer chemischen Reaktion oder Enzymkatalyse spezifische molekulare Sonden kovalent an Zielmodifikationen oder modifizierende Reste zu binden, gefolgt von einer Proteomanalyse. Dieser aufkommende Ansatz in der Chemoproteomik gewinnt bei der Untersuchung von Proteinmodifikationen mit geringer Häufigkeit wie Palmitoylierung, Myristoylierung und Glykosylierung an Bedeutung. Es bietet insbesondere den Vorteil, dass es in lebenden Zellen anwendbar ist und dadurch potenzielle Störungen wie Oxidation aufgrund von Zellstress umgangen werden.

Technischer Service
1. Posttranslationale Cystein-Modifikationen
Cystein (Cys) ist eine häufig vorkommende schwefelhaltige Aminosäure in Proteinen, und seine Thiolgruppe spielt eine entscheidende Rolle bei der Regulierung der molekularen Redoxhomöostase und beeinflusst enzymatische Reaktionen, Protein-Protein-Wechselwirkungen und Proteinstabilität durch verschiedene posttranslationale Modifikationsprozesse. Zu den häufigen posttranslationalen Modifikationen von Cystein gehören Palmitoylierung, Nitrosylierung, Sulfenylierung und Sulfonierung. Colosseum Biosciences hat universelle Sonden oder metabolische Markierungsstrategien entwickelt, die auf Cysteinreste abzielen, und entsprechende chemische Proteomikplattformen für die Identifizierung posttranslationaler Modifikationen etabliert. Diese Plattform identifiziert Zielproteine und Modifikationsstellen posttranslationaler Modifikationen genau.
2. Posttranslationale Lysin-Modifikationen
Lysin (Lys) ist eine der Aminosäuren mit den vielfältigsten posttranslationalen Modifikationen (PTMs) im Proteom. Reversible posttranslationale Lysinmodifikationen (Lys-PTMs) sind häufige biochemische Prozesse, die eine unverzichtbare Rolle bei der Regulierung zahlreicher kritischer Zellfunktionen spielen. Posttranslationale Modifikationen an Lysin umfassen Acetylierung, Succinylierung, Propionylierung, Butyrylierung, Crotonylierung, Malonylierung und Lactylierung. Colosseum Biosciences hat eine Technologieplattform für chemische Proteomik entwickelt, die auf chemischen Sonden für posttranslationale Modifikationen von Lysin basiert und Zielproteine und Modifikationsstellen genau identifiziert.
3. Posttranslationale Serin/Threonin-Modifikationen
Häufige posttranslationale Modifikationen an Serin (Ser) und Threonin (Thr) umfassen hauptsächlich Phosphorylierung, O-Glykosylierung usw. Diese Modifikationen wirken sich erheblich auf den Aktivitätszustand von Proteinen und ihre Wechselwirkungen mit anderen Molekülen aus und spielen eine wichtige Rolle in verschiedenen wichtigen biologischen Prozessen. Daher ist die Analyse dieser Art posttranslationaler Modifikation ein wichtiges Thema in der Proteinfunktionsforschung. Colosseum Biosciences nutzt Materialien zur Phosphorylierungsanreicherung, nicht-natürliche chemische Glykansonden und andere Werkzeuge, um Zielproteine und Modifikationsstellen für diese Art der posttranslationalen Modifikation genau zu identifizieren.
Unsere Vorteile
01. Hochprofessionell:Unterstützt durch die Forschungsgruppe von Professor Wang Chu von der Peking-Universität, dem leitenden Wissenschaftler unseres Unternehmens.
02. One-Stop-Plattform:Umfasst den gesamten Arbeitsablauf vom Sondendesign, der Sondensynthese, der Zielerkennung bis hin zur bioinformatischen Analyse.
03. Kein Bedarf an Antikörpern:Spezifische chemische Sondenmodifikation,Physiologisch
04. Umwelt:Anwendbar sowohl in Lysaten als auch in lebenden Zellen.
05. Umfangreiche Erfahrung:Gesammeltes Fachwissen in über 10 verschiedenen Arten von PTMs
06. Hochleistungsplattform:Thermo Fisher Orbitrap Exploris 480,Thermo Fisher Q Exactive HF-X,Bruker timsTOF
Fallstudie
Unter Itaconation versteht man den Prozess, bei dem Itaconat während der posttranslationalen Modifikation kovalent an bestimmte Stellen auf Proteinen bindet. Diese Modifikation kann die Struktur und Funktion des Proteins verändern und seine Rolle innerhalb der Zelle beeinflussen. Beispielsweise kann Itaconation die Aktivität, Stabilität oder Wechselwirkungen von Enzymen mit anderen Molekülen regulieren. Da Itaconat ein Zwischenprodukt im Tricarbonsäurezyklus ist, ist diese Modifikation eng mit dem Stoffwechselzustand der Zelle verknüpft. Untersuchungen haben gezeigt, dass die Itaconation eine bedeutende Rolle in der Pathologie bestimmter Krankheiten spielt, und das Verständnis dieses Modifikationsmechanismus könnte bei der Entwicklung neuer Therapiestrategien hilfreich sein.
Die mit ITalk-Sonden auf lebender Zellebene metabolisch markierten Zellen wurden lysiert, gefolgt von einer Klickreaktion, Anreicherung, Enzymverdauung und anderen Schritten, um den spezifischen Ort der Itaconsäure-Ansäuerung zu bestimmen.