Produkte
Posttranslationale Serin/Threonin-Modifikationen
Posttranslationale Serin- und Threonin-Modifikationen (PTMs) beziehen sich auf die chemischen Modifikationen, die Proteine nach der Synthese durchlaufen, wobei Phosphorylierung und Glykosylierung die häufigsten Formen der Modifikation sind. Die PTMs an Serin- und Threoninresten umfassen hauptsächlich Phosphorylierung und O-Glykosylierung. Nach der Modifikation können diese Aminosäurereste die Aktivität, Stabilität und Interaktionsfähigkeiten des Proteins erheblich verändern und spielen dadurch eine entscheidende Rolle bei der Signalübertragung von Zellen, der Stoffwechselregulation und anderen wichtigen biologischen Prozessen. Eingehende Untersuchungen dieser Veränderungen helfen dabei, die molekularen Mechanismen hinter den Lebensaktivitäten aufzudecken und könnten neue Angriffspunkte für die Behandlung von Krankheiten liefern. Daher sind Serin- und Threonin-PTMs sowohl in der biologischen Grundlagenforschung als auch in klinischen Anwendungen von unverzichtbarer Bedeutung.
Chomix verfügt über fortschrittliche Massenspektrometrietechnologie, die in der Lage ist, verschiedene Arten von posttranslationalen Proteinmodifikationen und ihre spezifischen Standorte direkt und präzise zu analysieren. Durch die geschickte Kombination von Trennanreicherungstechniken und Isotopenmarkierung können groß angelegte qualitative und quantitative Analysen verschiedener Modifikationen mit hohem Durchsatz durchgeführt werden, was eine solide technische Unterstützung für eine eingehende Forschung zu posttranslationalen Proteinmodifikationen bietet.
Technische Plattform (O-Glykosylierung)
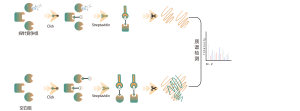
Die O-verknüpfte Glykosylierung ist ein biochemischer Prozess, der Zuckerketten auf die Sauerstoffatome von Serin- und Threoninresten in Peptidketten überträgt. Mithilfe der Reagenzien UDP-GalNAz und Y289L GalT1 können diese Wirkstoffe Zuckermoleküle an Glykosylierungsstellen mit einer -N3-Gruppe markieren. Nachfolgende Schritte einschließlich Klick-Chemie, enzymatischer Verdauung, Anreicherung und hochauflösender Massenspektrometrie ermöglichen die genaue Identifizierung von O-Glykosylierungsstellen und offenbaren so die entscheidende Rolle dieser posttranslationalen Modifikation in Organismen.

Unsere Vorteile
1. Fachkompetenz: Mit umfangreicher Erfahrung und Veröffentlichungen in führenden Fachzeitschriften bieten wir maßgeschneiderte Dienstleistungen für optimale Ergebnisse.
2. Strenges Qualitätsmanagement: Unsere ausgereiften Qualitätssysteme entsprechen den ISO9001-Standards und gewährleisten zuverlässige Berichte.
3. Umfassender Service: Vom Sondendesign bis zur bioinformatischen Analyse bieten wir eine umfassende Beratung bis zur Lieferung mit zeitnahen Fortschrittsaktualisierungen.
4. Fortschrittliche Ausrüstung: Ausgestattet mit modernsten Massenspektrometern wie Thermo Fisher Orbitrap Exploris 480 und Bruker timsTOF unterstützen wir bahnbrechende Forschung.
Unser Service
| Projekt | Posttranslationale Serin/Threonin-Modifikationen basierend auf hochauflösender Massenspektrometrie |
| Probe | Lysat, lebende Zellen, Gewebeproben |
| Hardwareplattform | VanquishNeo UPLC gekoppelt mit Orbitrap Exploris 480 Massenspektrometer (Thermo Fisher Scientific); EASY-nLC1200 UPLC gekoppelt mit Q Exactive HF-X Massenspektrometer (Thermo Fisher Scientific) |
| Projektdauer | 4-8 Wochen |
| Leistungen | Projektbericht (einschließlich Gelbildern, Standortinformationen usw.) |
| Preis | Klicken Sie hier, um sich zu beraten |
Fallstudie
Projektziel: Ziel dieses Projekts ist die Durchführung einer eingehenden chemischen Proteomanalyse der posttranslationalen O-GlcNAcylierungsmodifikation mithilfe der Massenspektrometrietechnologie.
Lösung: Wir verwenden einen kombinierten Ansatz aus metabolischer Markierung und Massenspektrometrie, um eine präzise und umfassende qualitative Analyse von O-Glykosylierungsstellen durchzuführen. Im experimentellen Prozess bestimmen wir zunächst die Menge des Y289L GalT1-Enzyms mithilfe der Fluoreszenz-Gel-Technologie, gefolgt von einer massenspektrometrischen Analyse unter streng definierten experimentellen Bedingungen. Durch zwei Runden wiederholter Experimente wurden insgesamt 36 zuverlässige Glykosylierungsstellen identifiziert. Es wird ein Beispiel für ein typisches MS2-Spektrum vorgestellt.