Enthüllung des Geheimnisses des kleinen Moleküls WA: Licht ins Dunkel der PHGDH-Enzymregulation bringen und den Weg für neuartige Krebstherapien ebnen
Serin, eine unverzichtbare Aminosäure, erfüllt verschiedene wichtige biologische Funktionen in lebenden Organismen. Es dient nicht nur als grundlegender Bestandteil der Proteinsynthese, sondern ist auch an der Regulierung zahlreicher Stoffwechselwege beteiligt, einschließlich der Nukleotidsynthese, des Methioninstoffwechsels und antioxidativer Funktionen. Unter diesen Wegen kommt der Phosphopyruvatdehydrogenase (PHGDH) eine zentrale Bedeutung zu, da sie den ersten Schritt des Serinsynthesewegs katalysiert und 3-Phosphoglycerat in 3-Phosphohydroxypyruvat umwandelt. Aufgrund seiner zentralen Rolle im Serinstoffwechsel ist jede Abweichung der PHGDH-Funktion eng mit der Entstehung und dem Fortschreiten zahlreicher Krankheiten, insbesondere Krebs, verbunden.
In diesem Artikel wird ein innovativer Ansatz vorgestellt, der chemische Proteomik und phänotypische Analysetechniken nutzt, um eine Verbindung zu identifizieren, die PHGDH kovalent hemmen kann. Während die meisten PHGDH-Inhibitoren typischerweise kompetitiver Natur sind, präsentieren die Autoren Withangulatin A (WA), ein natürliches kleines Molekül, als neuartigen kovalenten Inhibitor von PHGDH. WA erweist sich als vielversprechende Leitverbindung für die Entwicklung von PHGDH-Inhibitoren. Darüber hinaus dient WA als wertvolle Sonde zur Untersuchung der Funktionalität von PHGDH und des Serinsynthesewegs (SSP). Durch die Nutzung dieses Inhibitors gewinnen Forscher tiefere Einblicke in die Regulierungsmechanismen, die den Serinstoffwechsel steuern, und eröffnen so Möglichkeiten für die Erforschung möglicher Behandlungsmodalitäten für verwandte Krankheiten, insbesondere Krebs.
Diese Entdeckung bietet nicht nur vielversprechende Hinweise für die Entwicklung neuartiger medikamentöser Behandlungsstrategien, sondern liefert auch entscheidende Erkenntnisse über die Rolle des Serinstoffwechsels beim Krankheitsverlauf.
Forschungsroute
Experimenteller Prozess
1. Vergleich von WP und WA in den Zytotoxizitätsexperimenten.
In der Studie entwickelte und synthetisierte der Autor eine zusammengesetzte Sonde mit der Bezeichnung WP. Unter Verwendung menschlicher Dickdarmkrebszellen (HCT-116) und normaler Dickdarmzellen (NCM460) stellten die Autoren fest, dass WP eine vergleichbare Zytotoxizität wie WA aufwies. Dies legt nahe, dass der Einschluss von Alkinmarkern die zytotoxischen Wirkungen nicht wesentlich veränderte. Darüber hinaus stellten die Autoren fest, dass WA in normalen Dickdarmzellen eine geringere Zytotoxizität aufwies, in Dickdarmkrebszellen jedoch eine höhere Zytotoxizität, was seine erhöhte Selektivität gegenüber Dickdarmkrebszellen unterstreicht.
Anschließend verwendeten die Autoren eine ABPP-Strategie (Activity-Based Protein Profiling) unter Verwendung der WP-Sonde in HCT-116-Zellen. Dieser Ansatz führte zur Identifizierung von PHGDH als direktes Zielprotein von WA. Die experimentelle Validierung erfolgte mittels WB-Pull-Down-Assays und bestätigte die Ergebnisse.
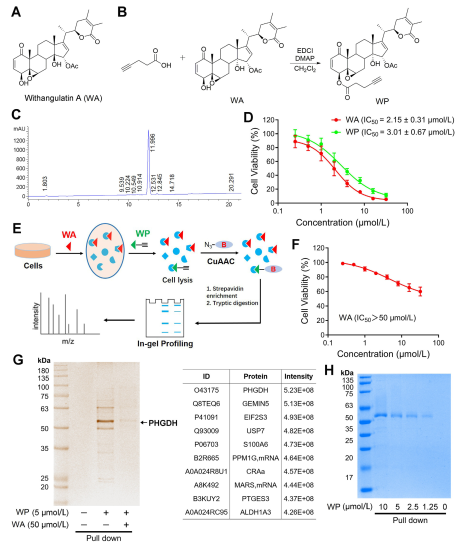
Abbildung 1: Chemischer Proteomics-Ansatz zur Identifizierung von Zielen von Withangulatin A.
2. Bestätigung der direkten Interaktion zwischen WA und PHGDH.
Mithilfe der ABPP-Technologie (Activity-Based Protein Profiling) identifizierten die Autoren PHGDH als direktes Ziel der Verbindung WA in HCT-116-Zellen. Um die Wechselwirkung zwischen WA und PHGDH zu validieren, führten die Autoren DARTS-Experimente (Drug Affinity Responsive Target Stability) und CETSA-Experimente (Cellular Thermal Shift Assay) durch. Die Ergebnisse zeigten, dass WA die thermische Stabilität von PHGDH erhöhte und dessen Aktivität deutlich hemmte. Darüber hinaus lieferten Biolayer-Interferometrie-Experimente (BLI) eine weitere Bestätigung der direkten Wechselwirkung zwischen WA und PHGDH.
Die Autoren untersuchten auch die irreversible Natur der WA-Bindung an PHGDH. Ihre Experimente zeigten, dass PHGDH die WP-Bindung verhinderte; Allerdings könnte eine Vorinkubation mit Lösungen, die N-Acetylcystein (NAC) oder Glutathion (GSH) enthalten, die Bindung von WP an PHGDH umkehren. Diese Ergebnisse legen eine irreversible kovalente Bindung zwischen WA und Cysteinresten im PHGDH-Protein nahe.
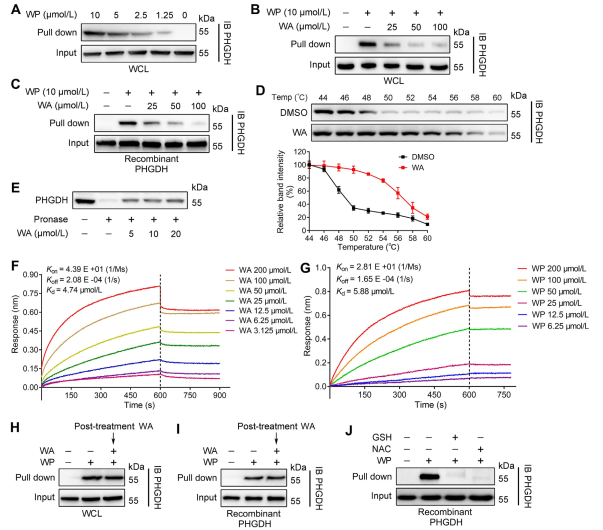
Abbildung 2: WA bindet direkt an PHGDH.
3. WA bindet über die α-β-ungesättigte Ketoneinheit kovalent an PHGDH.
Um den Mechanismus, durch den WA mit PHGDH interagiert, weiter aufzuklären, führten die Forscher Experimente durch, um die kovalente Bindung von WA an PHGDH über seine α-β-ungesättigte Ketonstruktur zu bestätigen. Zunächst wurden die α,β-ungesättigten Ketonfragmente von WA reduziert, um WA-1 zu erzeugen (siehe Teil Abbildung 3A). Nachfolgende Analysen unter Verwendung von Cell Counting Kit-8 (CCK-8)-Assays und Pull-Down-Protein-Interaktionsassays (siehe Abbildung 3B) zeigten, dass die zytotoxische Wirkung von WA tatsächlich von seiner α- und β-ungesättigten Ketonstruktur abhängt. Im Gegensatz dazu konnte WA-1 die Bindung von PHGDH an WP nicht wirksam verhindern (siehe Abbildung 3C und D), wodurch die kovalente Bindung des β-ungesättigten Ketons an PHGDH weiter bestätigt wurde (siehe Abbildung 3E).
Angesichts der bedeutenden Rolle der Hemmung oder Abwesenheit von PHGDH bei der Blockierung von Prozessen des Serinsynthesewegs (SSP) in Tumorzellen untersuchten die Autoren die Wirkung von WA auf die SSP-Aktivität in HCT-116-Zellen mithilfe der stabilen Isotopenmarkierung mit U-13C-Glucose (siehe). zu Abbildung 3J). Experimentelle Ergebnisse zeigten, dass WA die SSP-Aktivität in HCT-116-Zellen wirksam hemmte.
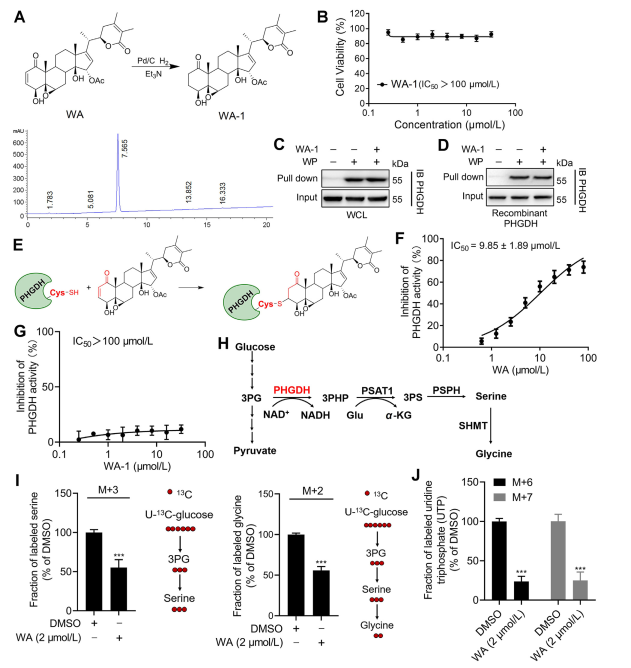
Abbildung 3: WA bindet kovalent an PHGDH und hemmt die PHGDH-Aktivität.
4. Der Cys295-Rest von PHGDH ist kovalent an WA gebunden.
Theoretisch können die α- und β-ungesättigten Ketoneinheiten von WA eine kovalente Bindung mit Cysteinresten des Proteins eingehen. Tatsächlich beobachteten die Autoren eine kovalente Modifikation der Cys295-Reste in PHGDH durch WA. Anschließend lieferten sie weitere Beweise für die kovalente Bindung von WA an die Cys295-Reste von PHGDH und zeigten, dass Mutationen an Cys295 die inhibitorische Aktivität von WA auf PHGDH signifikant reduzierten. Darüber hinaus ergaben Biolayer-Interferometrie-Experimente (BLI) keine Wechselwirkung zwischen WA und dem rekombinanten Cys295A-PHGDH-Protein, was die selektive kovalente Bindung von WA an PHGDH bestätigte.
Darüber hinaus deuteten Molekulardynamiksimulationen darauf hin, dass WA als allosterischer Regulator von PHGDH fungiert, wobei der Cys295-Rest möglicherweise als neue allosterische Stelle für PHGDH dient.
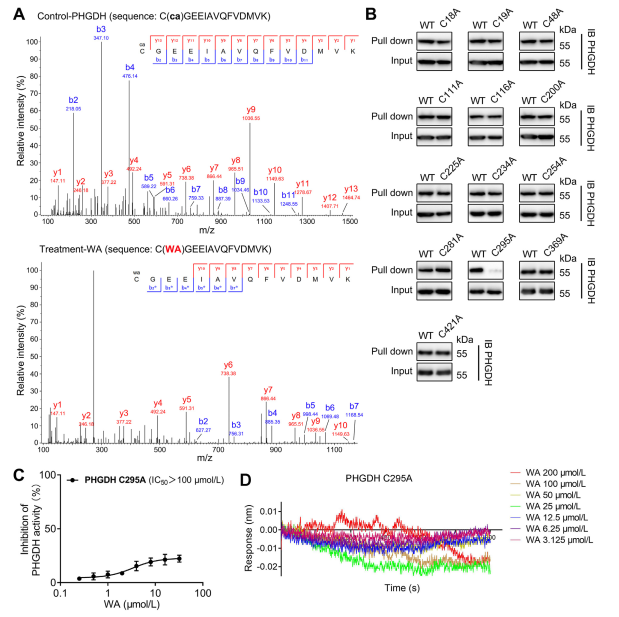
Abbildung 4. WA bindet selektiv kovalent an die Cys295-Reste von PHGDH.
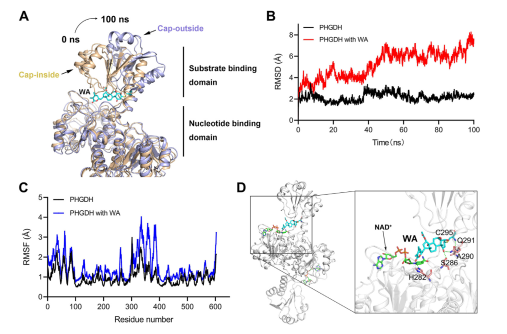
Abbildung 5: Cys295-Rest als allosterische regulatorische Stelle von PHGDH
5. Die Wirkung von WA auf das Redoxgleichgewicht in HCT-116-Zellen.
Der Serinsyntheseweg (SSP) spielt eine entscheidende Rolle bei der Aufrechterhaltung des zellulären Redoxgleichgewichts, indem er Vorläufer für die Glutathion (GSH)-Synthese und die NADPH-Produktion bereitstellt, die für Redoxreaktionen unerlässlich sind. Die Autoren untersuchten den Einfluss von WA auf das Redoxgleichgewicht in HCT-116-Zellen und stellten fest, dass WA zu einem Anstieg der reaktiven Sauerstoffspezies (ROS) führte und folglich die GSH/GSSG- und NADPH/NADP+-Verhältnisse verringerte, was auf erhöhten oxidativen Stress hinweist.
Die Western-Blot-Analyse ergab eine erhöhte Expression von γ H2AX, gespaltener Caspase3 und gespaltenem PARP sowie eine verminderte CHK2- und Cyclin-D1-Expression, was auf eine Induktion von Apoptose durch WA schließen lässt. Darüber hinaus führte der Verlust von PHGDH zu einer erhöhten ROS-Produktion, einer gehemmten Proliferation von HCT-116-Zellen und einer verringerten Zytotoxizität von WA in Zellen mit geringer PHGDH-Expression. Diese Ergebnisse unterstreichen die Rolle von PHGDH bei der ROS-Produktion und der WA-vermittelten Zytotoxizität in HCT-116-Zellen.
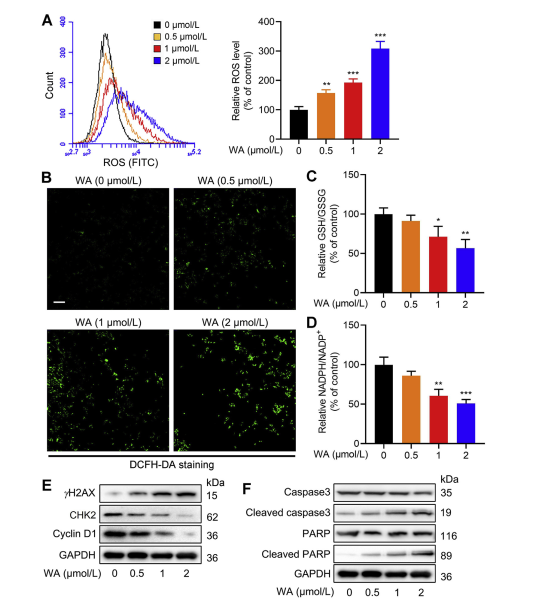
Abbildung 6: WA erhöht den intrazellulären ROS-Spiegel in HCT-116-Zellen
6. Zellproliferationseffekt in Xenograft-Modellen.
Um den Einfluss von WA auf die Proliferation von HCT-116-Zellen in vivo zu bewerten, erstellten die Autoren ein Xenotransplantatmodell unter Verwendung von HCT-116-Zellen. Die Ergebnisse zeigten, dass WA keine signifikanten Auswirkungen auf das Körpergewicht oder die Organmorphologie hatte, was auf eine geringe Toxizität hinweist.
Um die Selektivität von WA für die PHGDH-Hemmung weiter zu untersuchen, erstellten die Autoren ein Xenotransplantatmodell unter Verwendung von PHGDH-Knockout (KO)-HCT116-Zellen. In diesem Modell hemmte das Fehlen von PHGDH deutlich die Proliferation von HCT-116-Zellen (siehe Abbildung 7, AC). Darüber hinaus war die Expression von Ki67, einem Marker für die Zellproliferation, im PHGDH KO HCT116-Zell-Xenotransplantatmodell deutlich reduziert (siehe Abbildung 7, D).
Bemerkenswert ist, dass WA im Xenotransplantatmodell unter Verwendung von PHGDH-KO-HCT-116-Zellen keine signifikante hemmende Wirkung auf die Zellproliferation zeigte (siehe Abbildung 7, EG), was weiter bestätigt, dass die hemmende Wirkung von WA auf HCT-116-Zellen von PHGDH abhängt.
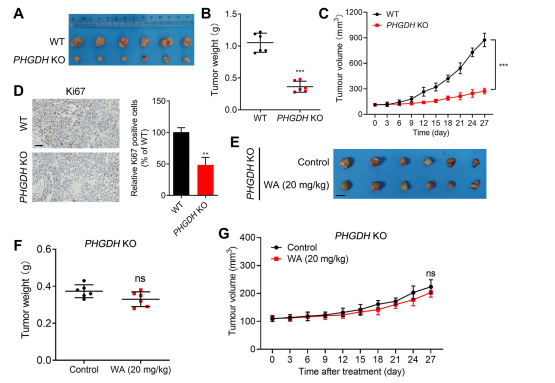
Abbildung 7: Wirkung von WA auf die Proliferation von PHGDH KO HCT-116-Zellen in vivo
Die Ergebnisse dieser Studie liefern nicht nur wichtige Hinweise für die zukünftige Entwicklung von Krebsmedikamenten für PHGDH, sondern bringen auch neue Hoffnung und Potenzial für die Entwicklung neuer Medikamente im Bereich der Krebstherapie.

