El análisis ABPP revela un nuevo mecanismo antiinflamatorio del ácido itacónico a través de interacciones proteína-metabolito
El papel del itaconato, un metabolito endógeno crucial para la inflamación y la regulación inmune, se aclara en un artículo conjunto del equipo de ChomiX Biotech. El estudio utilizó de manera innovadora la tecnología ABPP para revelar que el itaconato modifica la S-glicosilación de los residuos de cisteína en enzimas glicolíticas clave, lo que afecta el metabolismo celular. Los investigadores mapearon las interacciones proteína-itaconato y descubrieron que el itaconato se une y regula directamente múltiples enzimas en la vía de la glucólisis, afectando su velocidad y dirección. Esta investigación avanza nuestro conocimiento de los mecanismos de control metabólico durante la inflamación relacionada con la enfermedad y demuestra la fuerza de ABPP para explorar cómo las moléculas pequeñas modulan las funciones de las proteínas. Como líder en proteómica química, Corolus BioScience ofrece soluciones integrales, que incluyen diseño de sondas, procesamiento de muestras, detección de alto rendimiento y análisis de datos, para ayudar a los clientes a descubrir mecanismos reguladores metabólicos similares.
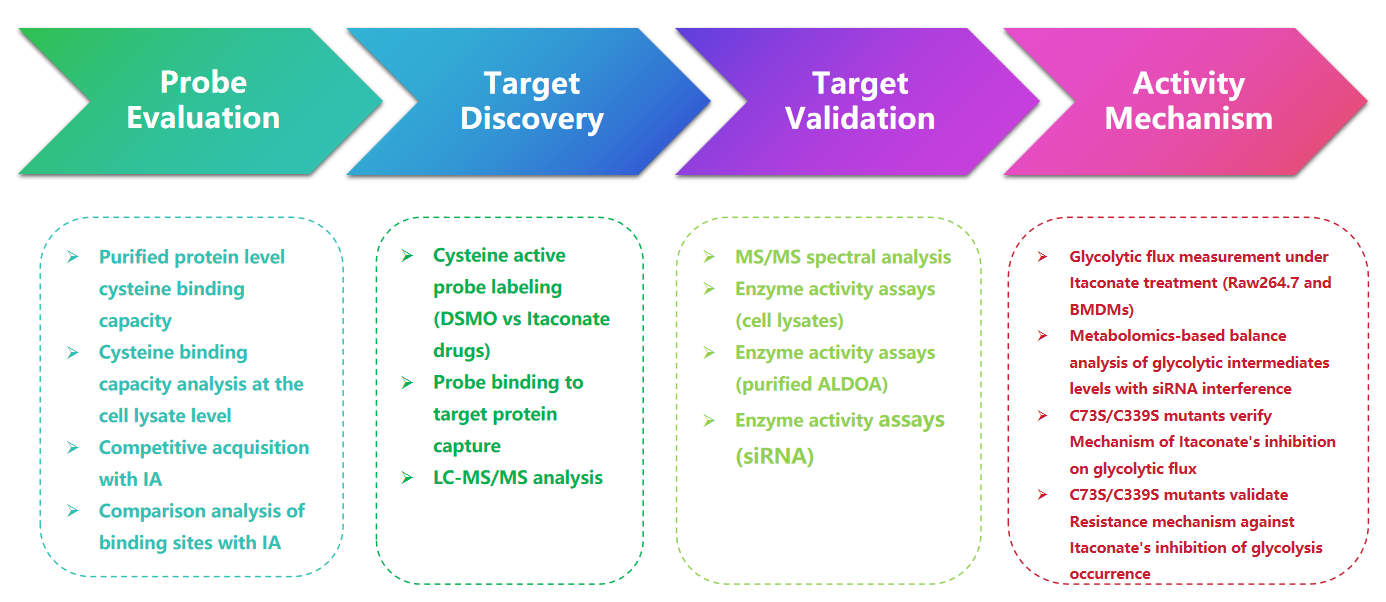
1. Detección de modificaciones de itaconato con la sonda 1-OH-Az
En este estudio, los autores emplearon técnicas avanzadas de elaboración de perfiles para investigar los residuos de cisteína dirigidos al itaconato. Inicialmente evaluaron la sonda 1-OH-Az mediante electroforesis en gel y realizaron experimentos competitivos utilizando IA-alquino. La validación por espectrometría de masas confirmó que 1-OH-Az marca selectivamente los sitios de cisteína, y que el 87% de las proteínas recientemente identificadas no estaban documentadas previamente como proteínas de unión a ligandos en DrugBank. Dadas las diversas funciones y la relevancia de estas proteínas en la enfermedad, la sonda 1-OH-Az se puede utilizar para identificar cisteínas activas como posibles objetivos farmacológicos para nuevas terapias.
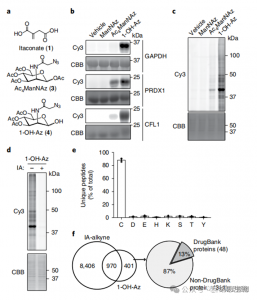
Figura 1: 1-OH-Az como sonda de análisis de cisteína eficaz y distintiva para detectar modificaciones de itaconato
2. Identificación de sitios de modificación de itaconato mediante técnicas de proteómica cuantitativa
Los investigadores realizaron experimentos isoTOP-ABPP para cuantificar los residuos de cisteína modificados por itaconato utilizando la sonda 1-OH-Az. Después del pretratamiento del lisado, se utilizó proteómica cuantitativa asistida por enlazadores marcados isotópicamente para analizar el impacto de diferentes concentraciones de itaconato, identificando sus objetivos específicos. También se realizaron experimentos comparativos utilizando dos concentraciones de IA-alquino, que, si bien mostraron una actividad y cobertura más amplias, solo reconocieron 65 y 50 sitios competidores efectivos. En particular, 1-OH-Az demostró una ventaja competitiva significativamente mayor entre las cisteínas cocuantificadas.
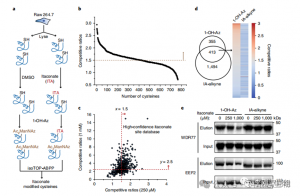
Figura 2: Análisis proteómico químico de cisteínas modificadas con itaconato utilizando isoTOP-ABPP competitivo con 1-OH-Az
3. El itaconato modifica e inhibe una enzima glicolítica clave
El análisis espectrométrico de masas reveló que el itaconato modifica tres enzimas glicolíticas clave: ALDOA, GAPDH y LDHA. La modificación endógena de itaconato en Cys73 y Cys339 de ALDOA se confirmó en células Raw264.7 estimuladas con LPS. Debido a su proximidad, los autores especularon que tales modificaciones podrían influir en la actividad de la aldolasa. De hecho, el tratamiento con itaconato 1 mM redujo la actividad de la enzima ALDOA sin afectar la expresión de proteínas. Además, los análisis de isoTOP-ABPP mostraron que Cys84 en LDHA y Cys245 en GAPDH también son objetivos para la modificación del itaconato.

Figura 3: El itaconato puede modificar y perjudicar la función ALDOA
4. El itaconato suprime principalmente la glucólisis dirigiéndose a ALDOA
Para evaluar el papel regulador de ITAC en la glucólisis inflamatoria de los macrófagos, los autores monitorearon el consumo de glucosa y la producción de lactato en células Raw264.7 antes y después de la estimulación con LPS, demostrando que ITAC disminuyó significativamente ambos, lo que indica una supresión de la función glucolítica. Para validar el efecto de ITAC sobre ALDOA y la posterior inhibición de la glucólisis, eliminaron la ALDOA endógena utilizando ARNi y sobreexpresaron ALDOA WT o doble mutante (C73S/C339S) en células Raw264.7. Como se esperaba, la eliminación de ALDOA resultó en una disminución del consumo de glucosa y la producción de lactato, lo que hizo que las células fueran insensibles al tratamiento con ITAC. La reintroducción de WT o ALDOA mutante restauró los niveles metabólicos en células no tratadas; sin embargo, las células que sobreexpresan el mutante ALDOA mostraron una sensibilidad reducida a la inhibición glucolítica en comparación con WT. Ensayos enzimáticos para la actividad aldolasa alineada con estados glicolíticos.
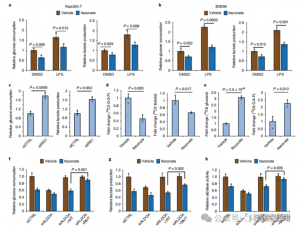
Figura 4: El itaconato altera la vía glicolítica mediante la modificación de ALDOA
5. La inhibición de ALDOA contribuye a las respuestas antiinflamatorias
Estos hallazgos revelaron que ITAC suprime la actividad de la vía glucolítica modificando los residuos de cisteína Cys73 y Cys339 en ALDOA. Los autores dedujeron además de la conocida acción antiinflamatoria del dimetilfumarato mediante la modificación de la cisteína en GAPDH y la inhibición glucolítica que ITAC puede retroalimentarse de manera similar para interferir con la glucólisis y ejercer un efecto antiinflamatorio. La eliminación de ALDOA redujo significativamente la secreción de IL-1β tras la estimulación con LPS, lo que sugiere su participación en la regulación de la inflamación a través de la glucólisis. La reversión parcial de los efectos antiinflamatorios de la eliminación de ALDOA con piruvato suplementado indicó un papel limitado de la LDHA en las respuestas inflamatorias.
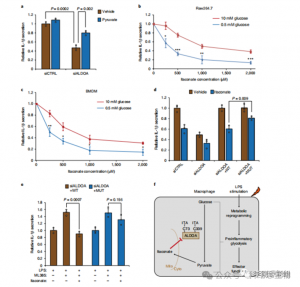
Figura 5: La acción antiinflamatoria del itaconato está mediada por su inhibición de ALDOA, lo que resulta en la interrupción de la glucólisis.
En resumen, este artículo aprovechó eficazmente las tecnologías de elaboración de perfiles de cisteína basadas en S-glicosilación y las metodologías ABPP para construir una red de interacciones entre el itaconato y las proteínas relacionadas. Demuestra de manera convincente que el itaconato sirve como un regulador metabólico crítico al modificar específicamente los residuos de cisteína en las proteínas para controlar la vía glucolítica. Esta investigación no sólo aclara el mecanismo de acción del itaconato como un nuevo regulador metabólico, sino que también proporciona pruebas sólidas de cómo los metabolitos pequeños interactúan con las proteínas para modular las vías metabólicas centrales.
Además de ABPP, otros métodos para estudiar las interacciones entre metabolitos de moléculas pequeñas y proteínas incluyen, entre otros:
1. Enriquecimiento de afinidad (desplegable)técnicas, en las que el compuesto nativo se convierte en una sonda biotinilada que se incuba con lisados celulares, seguido del enriquecimiento mediado por estreptavidina y el aislamiento de dianas proteicas que se unen a la sonda de biotina.
2.Espectrometría de masas con proteólisis limitada (LiP-MS)es una tecnología de descubrimiento de objetivos basada en la afinidad de proteínas. Cuando ligandos específicos, como fármacos o moléculas pequeñas, se unen a proteínas particulares, inducen cambios conformacionales o impedimentos estéricos que conducen a sitios de escisión diferenciales en comparación con la proteína no unida. Al detectar estas diferencias mediante espectrometría de masas, este método puede identificar interacciones fármaco-proteína dentro de las células y determinar los objetivos moleculares del fármaco.
3.Ensayo de cambio térmico celular (CETSA)se desarrolló inicialmente para ayudar en la investigación de objetivos de fármacos contra el cáncer y es uno de los primeros métodos sin etiquetas ampliamente utilizados para estudiar la interacción del objetivo de fármaco en células intactas. CETSA se basa principalmente en el principio de que al unirse a una proteína objetivo, un compuesto aumenta su estabilidad térmica. Después de incubar muestras con el compuesto y los controles correspondientes a varios gradientes de temperatura, las proteínas unidas al ligando permanecen plegadas y relativamente estables después del calentamiento, mientras que las proteínas no unidas se despliegan y precipitan debido a la desnaturalización. El análisis posterior de la termoestabilidad de las proteínas solubles mediante métodos basados en inmunotransferencia o espectrometría de masas, basados en sus curvas de fusión, confirma la interacción entre el compuesto y las proteínas intracelulares.
4. Cromatografía de afinidadImplica conjugar el metabolito objetivo con una matriz en fase sólida para capturar complejos de proteínas que interactúan con él. Luego, las proteínas capturadas se identifican mediante técnicas como la espectrometría de masas.
5.Resonancia de plasmón superficial (SPR)se utiliza para la medición en tiempo real y sin etiquetas de parámetros cinéticos asociados con las interacciones entre moléculas pequeñas y proteínas.
6. Cristalografía de proteínasaclara las estructuras tridimensionales de proteínas complejadas con ligandos de moléculas pequeñas, proporcionando una visión intuitiva de los sitios de unión y los mecanismos de acción. Al resolver estas estructuras, los investigadores pueden visualizar directamente cómo las moléculas pequeñas interactúan con sus proteínas dianas.

