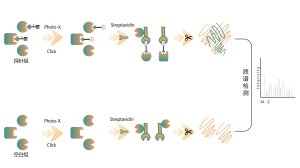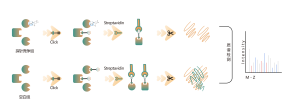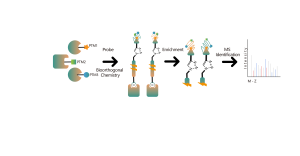Productos
Perfil quimioproteómico de dianas proteicas para fármacos de moléculas pequeñas no covalentes
Características técnicas de la plataforma
Los fármacos de molécula pequeña desempeñan un papel importante en el campo de la I+D de fármacos. Los medicamentos actualmente aprobados por la FDA se dirigen a un total de 812 proteínas humanas distintas. Entre los fármacos dirigidos contra las dianas mencionadas anteriormente, el 84% son fármacos de molécula pequeña. Además, sólo 639 de estas proteínas han sido atacadas con fármacos de molécula pequeña. La interacción entre el fármaco de molécula pequeña y la proteína objetivo incluye modos covalentes y no covalentes, y el primero es actualmente dominante.
Las interacciones no covalentes, como los enlaces de hidrógeno y el apilamiento π-π, pueden verse alteradas debido a la desnaturalización de las proteínas. Para abordar este desafío, nuestra plataforma emplea etiquetado de fotoafinidad, una técnica bien establecida para unir con precisión "etiquetas químicas" al sitio activo de una proteína. Además, nuestra innovadora estrategia de reticulación química in situ transforma las interacciones transitorias de proteínas no covalentes en enlaces químicos covalentes y permanentes. Al utilizar una sonda química funcionalizada con restos de fotoafinidad y bioortogonales, la plataforma de quimioproteómica de ChomiX ha demostrado su eficacia para detectar objetivos proteicos dentro de lisados celulares, tejidos y células vivas. El espectro de fármacos bioactivos de moléculas pequeñas aplicados en la plataforma abarca una variedad de compuestos, incluidos metabolitos endógenos, productos naturales y moléculas sintéticas no covalentes.

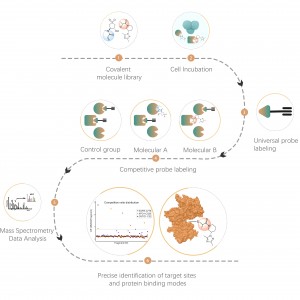
Flujo de trabajo

La plataforma sigue un flujo de trabajo estructurado, que comienza con el etiquetado de células vivas utilizando una sonda de fotoafinidad derivada de moléculas no covalentes. Los pasos posteriores incluyen la extracción de proteomas marcados, ligadura bioortogonal, enriquecimiento basado en estreptavidina, digestión con proteasas, marcaje isotópico y, finalmente, detección por espectrometría de masas.
Estudio de caso
Objetivo del proyecto
El compuesto A mostró una buena actividad antiproliferación en el ensayo de viabilidad celular. Se utilizó una plataforma de quimioproteómica para caracterizar las proteínas dianas.
Método experimental
La sonda química de fotoafinidad, Sonda A, se diseñó y sintetizó basándose en los datos SAR del compuesto A. La sonda A también mostró una actividad antiproliferación similar en la línea celular tumoral. Se realizaron experimentos basados en gel y MS. Los datos de MS se analizaron para dilucidar MOA.
Visualización de datos

Los resultados de la fluorescencia basada en gel mostraron que la sonda A podía marcar proteínas de manera efectiva, y que la señal de etiquetado podía competir significativamente con el compuesto A. En conjunto, estos datos indicaron que la sonda A podía usarse como herramienta de sonda química para el descubrimiento posterior de objetivos desde podría unirse a las mismas proteínas que el compuesto A.



El gráfico del volcán mostró que 114 proteínas (resaltado en rojo) fueron enriquecidas significativamente por la Sonda A en el grupo Sonda A versus DMSO (directo), y 38 proteínas (resaltado en rojo) compitieron significativamente con el compuesto A en el grupo Sonda A versus (A+Sonda A). ) Grupo (Competencia). Los diagramas de Venn mostraron que 32 proteínas superpuestas podrían ser objetivos potenciales de unión del compuesto A con gran confianza.(n = 3, relación ≥2,valor p ≤ 0,05)