Uso de proteómica química para identificar el objetivo funcional SLC25A20 del mebutato de ingenol para la queratosis actínica
Este estudio utiliza proteómica química para revelar un nuevo objetivo de butilato de metilo de macromorol (Ing-Meb), un fármaco empleado en el tratamiento de la queratosis solar. Inicialmente, el equipo de investigación ideó y sintetizó una sonda de fotoafinidad Ing-Meb llamada Ing-Dayne, que forma enlaces covalentes con proteínas objetivo tras la exposición a la luz ultravioleta, lo que facilita la identificación de posibles objetivos funcionales. Mediante validación posterior, los autores identificaron SLC25A20 como un objetivo fundamental de Ing-Meb. SLC25A20 es una translocasa de carnitina-acilcarnitina unida a la membrana mitocondrial implicada en el metabolismo de los ácidos grasos. En particular, la acción inhibidora de Ing-Meb sobre la función SLC25A20 conduce a una mayor acumulación de acilcarnitinas de cadena larga, lo que demuestra que Ing-Meb provoca sus efectos terapéuticos al modular la vía de oxidación de ácidos grasos. Además, el estudio profundiza en la importancia de las modificaciones estructurales en las investigaciones de productos naturales. Al sintetizar la sonda de fotoafinidad Ing-Dayne mediante la modificación estructural de Ing-Meb, los investigadores descubrieron con éxito un objetivo novedoso distinto del conocimiento convencional. Esto no sólo mejora la comprensión del Ing-Meb y su modo de acción, sino que también subraya el papel fundamental de la modificación estructural en la investigación de la proteómica química para desentrañar las complejidades de los productos naturales. Estos conocimientos impulsan aún más la innovación farmacológica, que abarca la optimización de la eficacia de los fármacos existentes, el desarrollo de nuevas terapias dirigidas a entidades específicas y la elucidación de los mecanismos de los efectos secundarios de los fármacos.
Ruta de investigación
Proceso experimental
1. El diseño de la sonda de fotoafinidad sintética Ing-Dayne revela el mecanismo subyacente a la unión del fármaco de queratosis actínica Ing-Meb a su proteína objetivo.
En este estudio, se empleó la sonda de afinidad Ing-Dayne, derivada del fármaco terapéutico para la queratosis actínica Ing-Meb (consulte la Figura 1). Mediante el cocultivo de esta molécula sonda con células específicas y la posterior irradiación con luz ultravioleta, la estructura doble de acridina dentro de la sonda formó enlaces covalentes estables con proteínas intracelulares. Tras la lisis celular, una reacción química Click facilitó la unión del grupo indicador azida-tetrametilrodamina a la proteína objetivo (como se ilustra en la Figura 2). El análisis SDS-PAGE posterior (representado en la Figura 3) reveló que Ing-Meb exhibió un efecto de unión competitivo significativo en la sonda, mientras que Ingenol, que posee una estructura similar, no demostró inhibición competitiva.
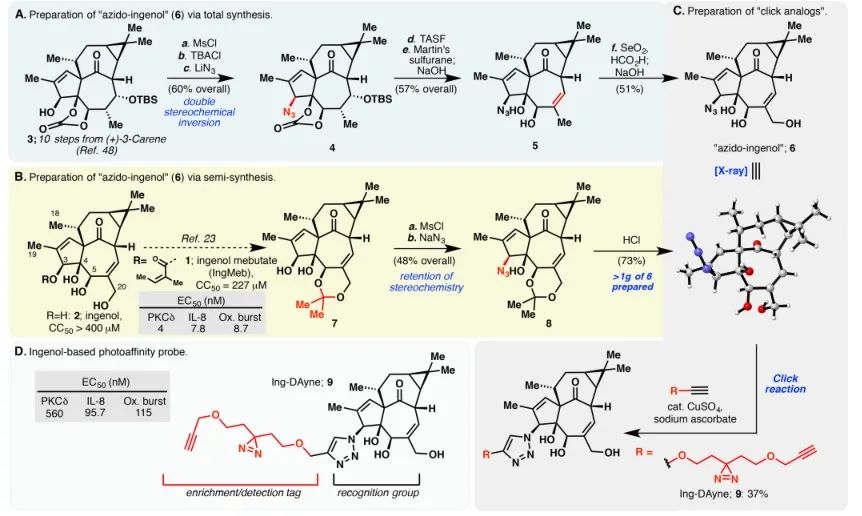
Figura 1: Ilustra las dos rutas sintéticas empleadas para la síntesis de Ing-Dayne.
2. La nueva sonda 11b ha identificado 44 proteínas diana de BBR relacionadas con la inflamación dentro de las células THP-1 y ha revelado que EIF2AK2, eEF1A1, PRDX3 y VPS4B son objetivos directos con interacciones específicas con BBR.
Los autores, a través de una serie de experimentos, emplearon con éxito la nueva sonda 11b para marcar y purificar posibles proteínas diana dentro de las células THP-1. Después de esto, utilizaron análisis LC-MS/MS para identificar 44 proteínas asociadas a la inflamación en el rango de peso molecular de 20 a 80 kDa, entre las cuales se encontró que seis desempeñaban papeles potencialmente críticos en las acciones antiinflamatorias de BBR. En investigaciones adicionales, se confirmó que EIF2AK2, eEF1A1, PRDX3 y VPS4B eran objetivos directos de BBR, y exhibían efectos de inhibición competitiva bajo altas concentraciones de tratamiento con BBR. Este hallazgo reveló la probable existencia de interacciones específicas entre estas proteínas y BBR, aclarando así nuevos conocimientos sobre su interacción con el fármaco durante sus procesos antiinflamatorios.
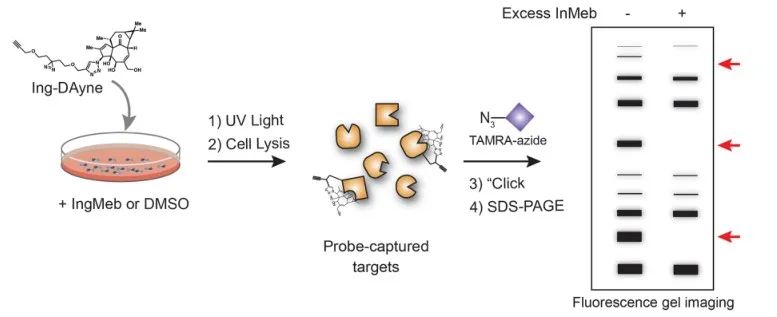
Figura 2: Proceso de validación basado en gel del objetivo Ing-Dayne.
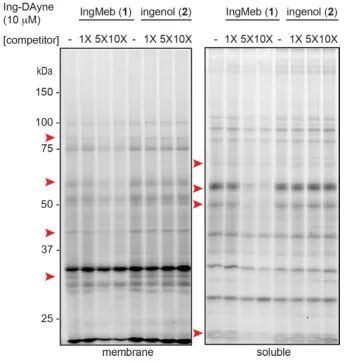
Figura 3: Inhibición competitiva de Ing-Meb e ingenol en la molécula sonda Ing-Dayne.
3. La detección SILAC, combinada con la validación de Western blot, identificó a SLC25A20 como el objetivo principal del fármaco Ing-Meb de clase Ingenol.
Inicialmente, los autores examinaron 28 proteínas diana potenciales utilizando la tecnología de etiquetado de isótopos estables mediante aminoácidos en cultivo celular (SILAC) (Figura 4). Posteriormente, a través de experimentos adicionales de detección y validación de transferencia Western (Figura 5), los investigadores observaron que Ing-Meb exhibía el efecto inhibidor más fuerte sobre SLC25A20 entre estos objetivos candidatos, lo que sugiere fuertemente que SLC25A20 es uno de los objetivos funcionales principales de Ing-Meb.
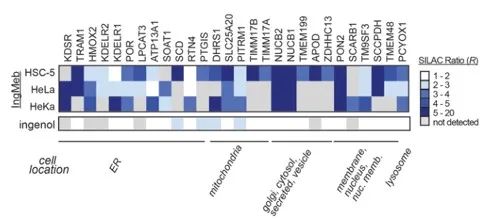
Figura 4: Los 28 objetivos potenciales obtenidos mediante el cribado inicial.
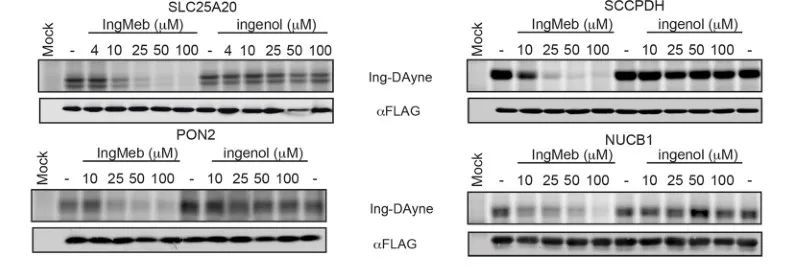
Figura 5: Experimentos de transferencia Western de cuatro posibles proteínas diana.
4. Ing-Meb regula la vía de oxidación de los ácidos grasos al inhibir SLC25A20, una proteína de la membrana mitocondrial también conocida como alcalilipoiltransferasa botulínica, revelando así su objetivo como fármaco para la queratosis actínica.
Los autores investigaron SLC25A20, también conocida como lipoiltransferasa alcalina botulínica o CACT, una proteína de membrana integral multimodal localizada dentro de la membrana mitocondrial. Su función principal implica el transporte de acilcarnitinas de cadena larga al interior de las mitocondrias, facilitando su intercambio con carnitina libre. Estas acilcarnitinas transportadas se convierten posteriormente en acilCoA grasa mediante la carnitina palmitoiltransferasa-2 (CPT-2), sirviendo así como precursores de la β-oxidación de ácidos grasos. Los hallazgos experimentales revelaron un aumento significativo en el contenido de acilcarnitina celular de cadena larga con concentraciones crecientes del fármaco para la queratosis actínica Ing-Meb (representado en la Figura 6). Esta observación respalda firmemente el efecto inhibidor de Ing-Meb sobre SLC25A20, lo que confirma que SLC25A20 es uno de los principales objetivos que median la acción de Ing-Meb.
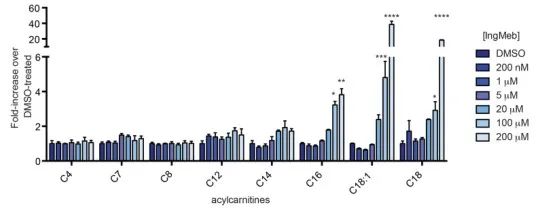
Figura 6: Efecto de Ing-Meb para las acilcarnitinas de cadena larga
5. Validación indirecta del efecto citotóxico de Ing-Meb mediante la expresión SLC25A20: revelando su función objetivo en la regulación de la actividad farmacológica.
Los investigadores intentaron vincular directamente la inhibición de SLC25A20 en células HeLa con los posibles efectos citotóxicos de Ing-Meb. Los resultados indicaron que, si bien la sobreexpresión de SLC25A20 no alteró la concentración inhibidora media de Ing-Meb en estas células, cabe destacar que el aumento de la expresión de SLC25A20 mitigó significativamente el impacto de Ing-Meb en la acumulación de acilcarnitina de cadena larga (representada en la Figura 7). . Este resultado corrobora aún más la hipótesis de que SLC25A20 sirve como un objetivo funcional fundamental para la actividad farmacológica de Ing-Meb.
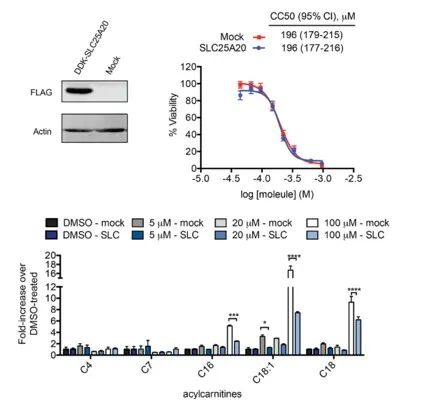
Figura 7: Efecto de la expresión o no de SLC25A20 sobre CC50 y acilcarnitina.
Este estudio no sólo revela los nuevos objetivos de Ing-Meb, sino que también proporciona una nueva base teórica y una dirección estratégica para el descubrimiento de productos naturales estructuralmente complejos. Referencia:
Referencia:https://doi.org/10.1021/acscentsci.7b00420.

