Antecedentes técnicos
La tecnología proteómica química surge como un faro de cambio, que aleja el descubrimiento de fármacos de las proteínas purificadas y lo acerca al ámbito de las células vivas.
La tecnología proteómica química sirve como una sólida plataforma de descubrimiento de fármacos, caracterizada por la investigación de interacciones entre pequeñas moléculas y proteínas dentro de las células vivas. Una de nuestras plataformas de descubrimiento de fármacos covalentes está diseñada para descubrir aglutinantes covalentes que atacan objetivos proteicos a través de reacciones covalentes con el grupo tiol de los residuos de cisteína. A diferencia de las estrategias tradicionales de detección de un solo objetivo, la plataforma de proteómica química permite el análisis cuantitativo de las interacciones entre fragmentos electrófilos y casi todas las proteínas de las células vivas con la resolución de residuos de aminoácidos. Cuenta con cobertura de más de 10.000 proteínas y~40.000 sitios de cisteína (posibles sitios de unión de fármacos) de varias líneas celulares de mamíferos.

Flujo de trabajo
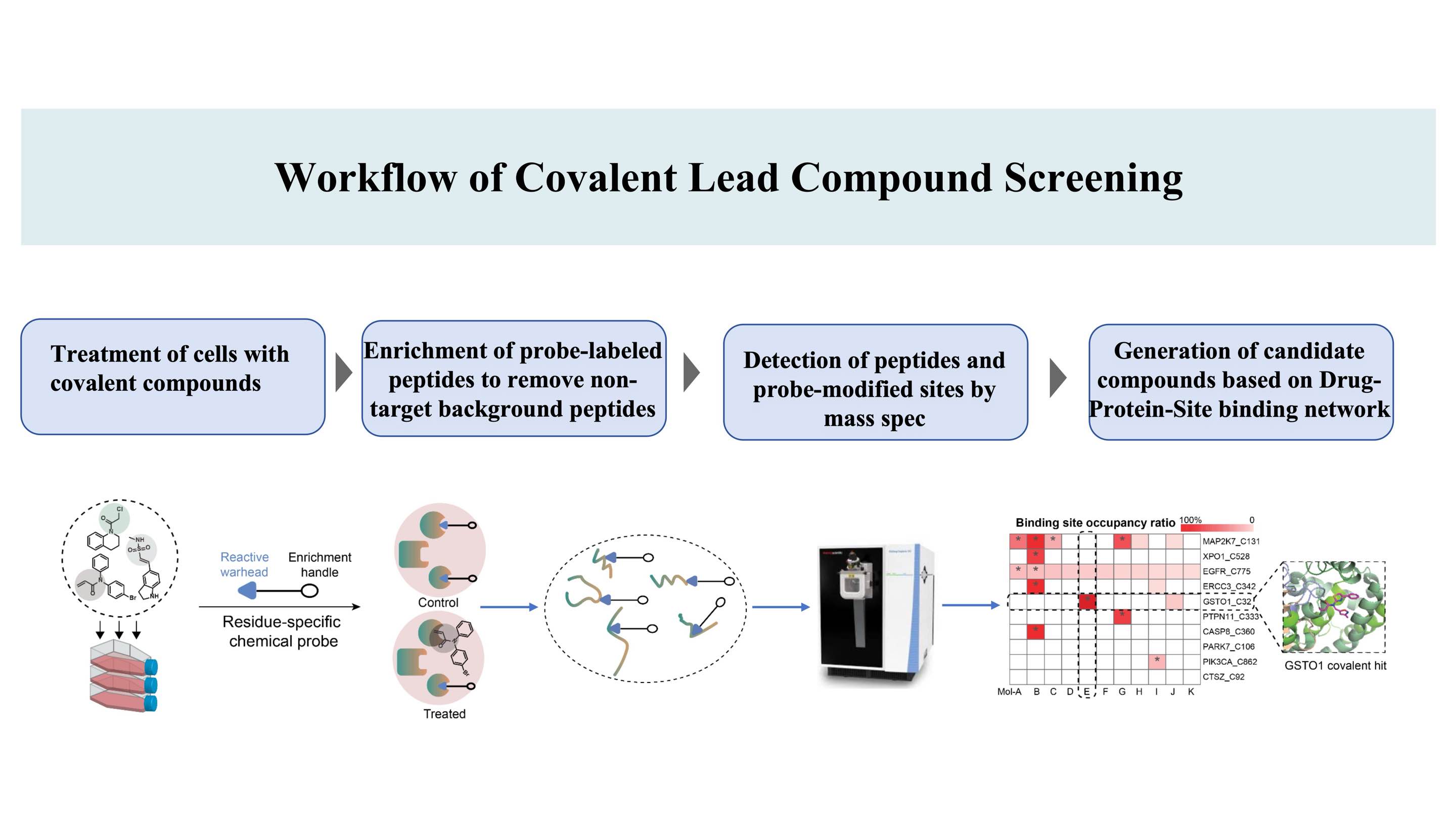
El flujo de trabajo para el descubrimiento de compuestos covalentes dirigidos a sitios de unión* en proteínas, basado en la patente DIA-ABPP (Data-Independent Acquisition-Activity-Based Protein Profiling) (un sitio de unión covalente es un aminoácido que puede marcarse mediante sondas químicas, permitiendo así la capacidad de ligadura)
Ventajas técnicas
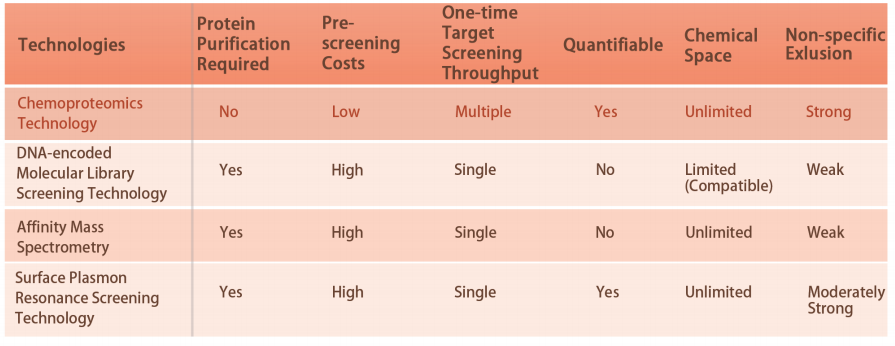
Característica 1
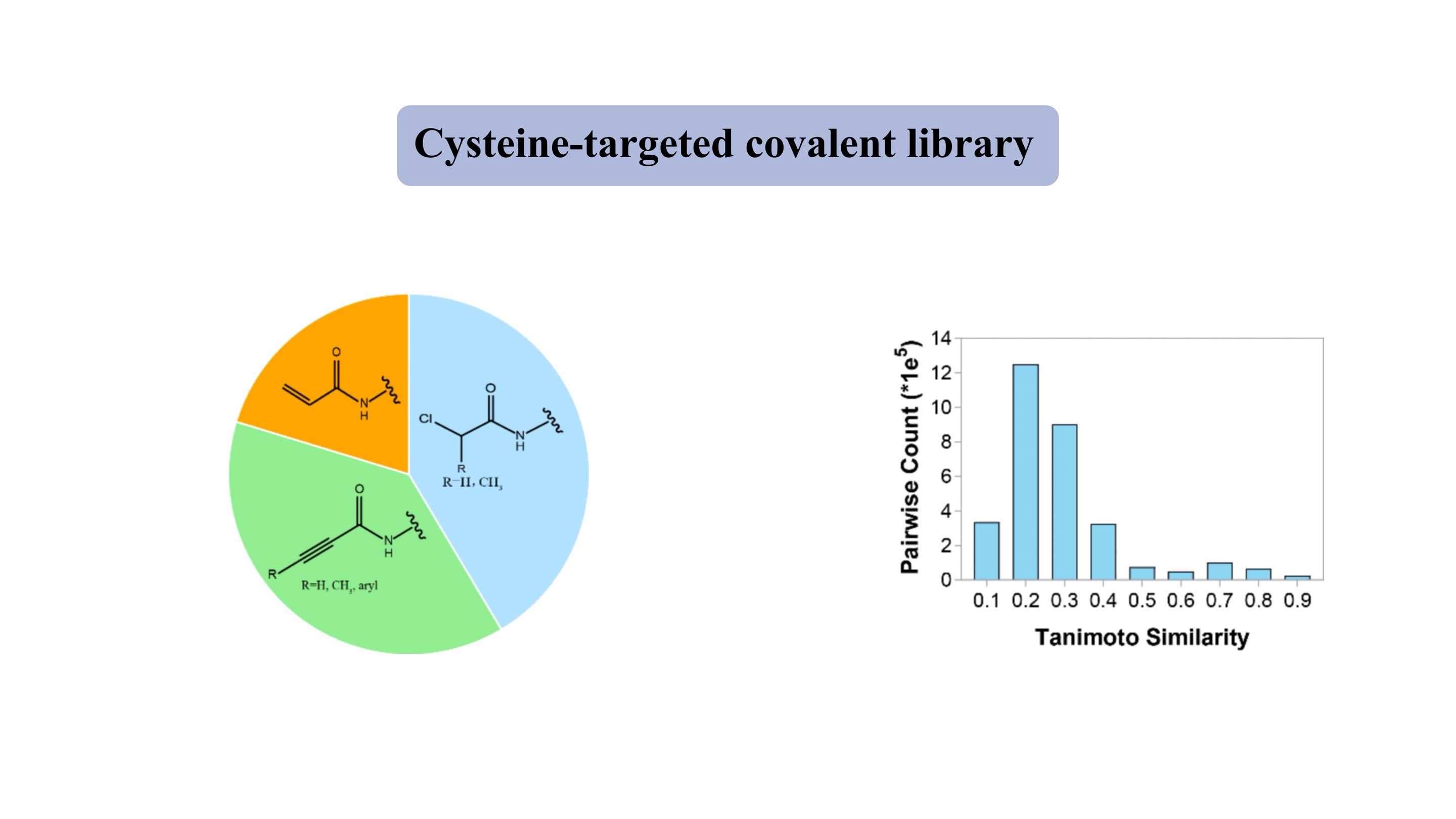
Biblioteca covalente dirigida a cisteína
La biblioteca covalente dirigida a cisteína contiene “ojivas” electrófilas suaves representativas, como acrilamidas y cloroacetamidas. La biblioteca "similar a un fármaco" contiene ~ 3000 compuestos, de los cuales más del 80% exhibe un peso molecular de 300-500 Da. Para la mayoría de los compuestos, el índice de similitud de Tanimoto es de alrededor de 0,3 por cada dos miembros, lo que indica un alto grado de diversidad.
Característica 2
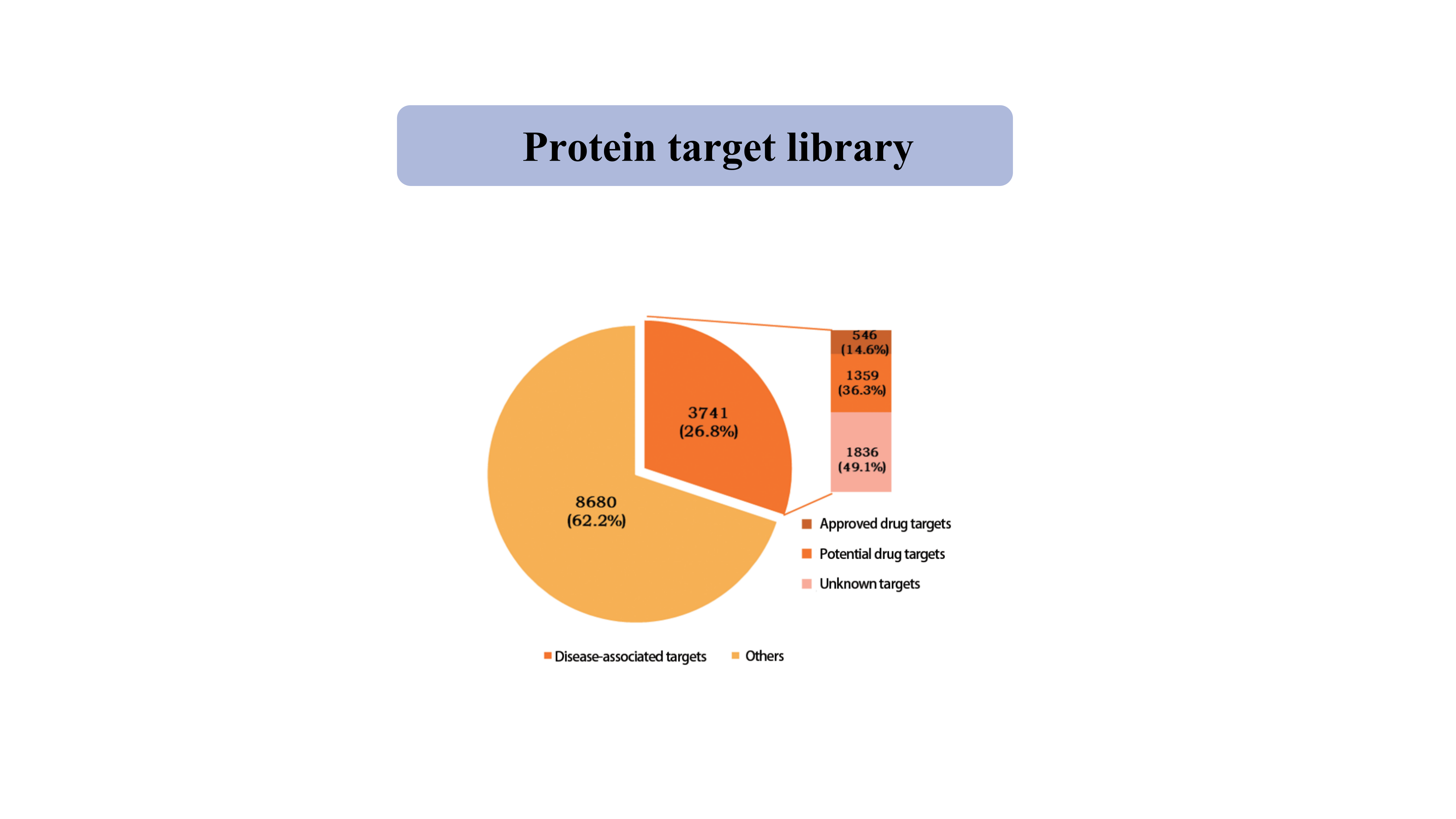
Objetivo proteicobiblioteca
Actualmente, la biblioteca de dianas proteicas capturadas por la sonda química específica de tiol cubre 39962 sitios de cisteína de 12421 proteínas, incluidas quinasas, fosfatasas, ligasas y factores de transcripción.
Estudio de caso
DCAF1 sirve como receptor sustrato para dos ligasas E3 distintas (CRL4DCAF1 y EDVP), y desempeña un papel fisiológico crítico en la degradación de proteínas. Se han desarrollado varios aglutinantes covalentes y no covalentes dirigidos al dominio WDR de DCAF1 para respaldar aplicaciones de degradación dirigida (Targeted Protein Degradation by Electrophilic PROTACs that Stereoselectively and Site-Specifically Engage DCAF1. J. Am. Chem. Soc. 2022, 144, 40, 18688 –18699 PROTAC basados en DCAF1 con actividad contra objetivos clínicamente validados. superación de la resistencia degradante intrínseca y adquirida. Nat. 2024, 15, 275).
Descubrimos por primera vez que Mol-380 se acopla covalentemente con DCAF1_C69, destacándolo como un posible sitio farmacológico para aplicaciones de TPD, separado del dominio WDR. Nuestros hallazgos resaltan el valor significativo de la plataforma proteómica química automatizada ChomiX para descubrir nuevos ligandos para objetivos no farmacológicos en células vivas, incluidos factores transcripcionales y proteínas de membrana, lo que subraya su impacto potencial en el desarrollo de fármacos y la exploración funcional.
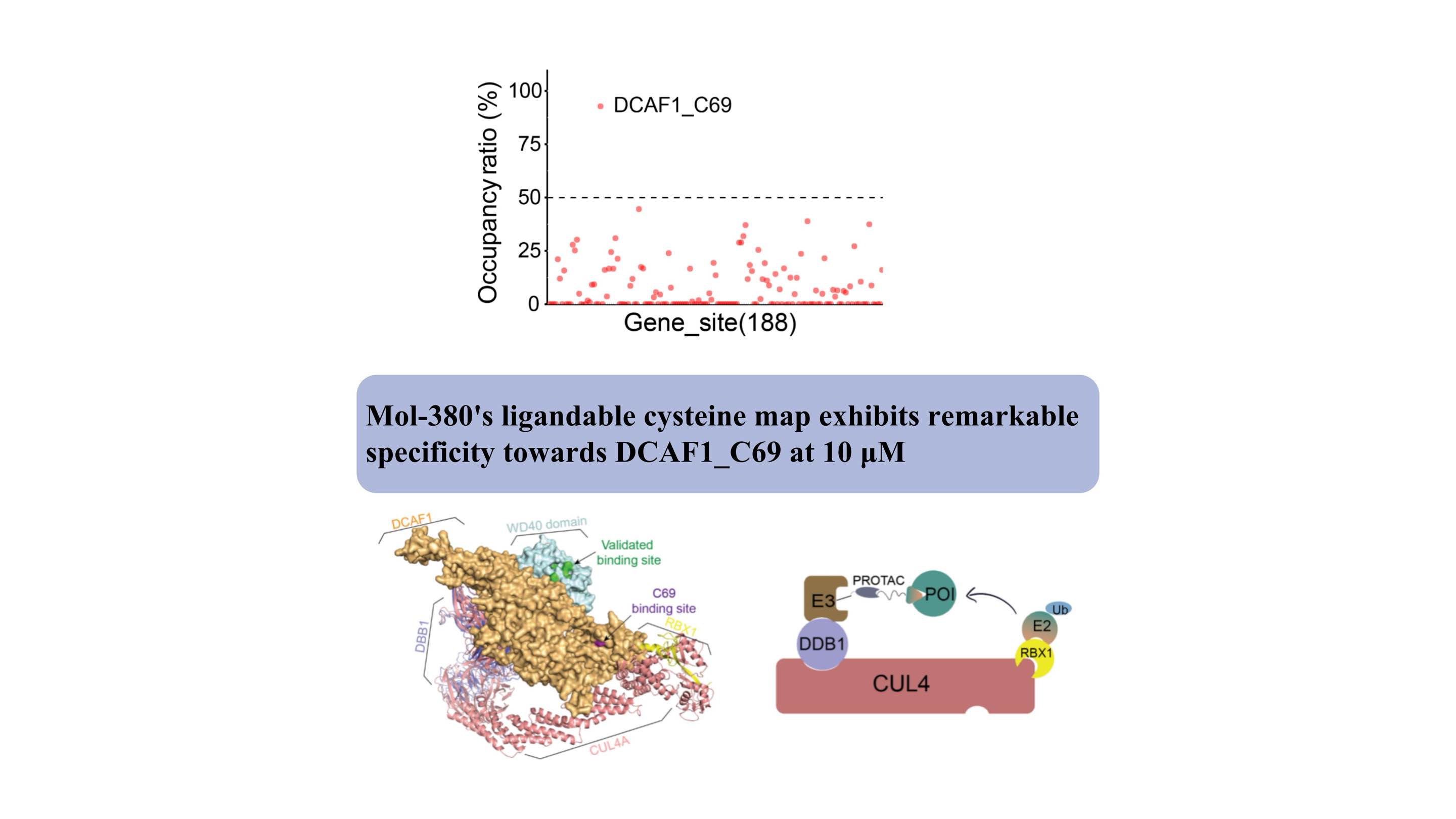
Estructuralmente, el sitio de unión de C69 se encuentra adyacente al bolsillo validado en el dominio WD40, como lo indica el modelo complejo, lo que ofrece un sitio novedoso para el desarrollo de PROTAC.

