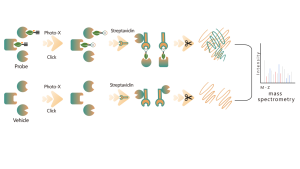Productos
Análisis ómico de modificaciones postraduccionales de cisteína
La cisteína, con su notable reactividad, desempeña un papel fundamental en la estructura y función de las proteínas. Al actuar como reactivo nucleofílico, centro catalítico redox, ligando de iones metálicos y sitio clave para cambios conformacionales, participa ampliamente e influye profundamente en la actividad de las proteínas y los mecanismos reguladores. Vale la pena señalar que los residuos de cisteína son propensos a sufrir varios tipos de modificaciones postraduccionales (PTM), que no solo ajustan con precisión las propiedades funcionales de las proteínas sino que también pueden conducir a un deterioro funcional. Dada la estrecha asociación de tales modificaciones con numerosas enfermedades humanas importantes, el análisis cualitativo y cuantitativo de los PTM de cisteína en las proteínas es de suma importancia. Esto tiene un valor indispensable para una comprensión profunda de las funciones biológicas de las proteínas relevantes y sus mecanismos de acción en estados de salud y enfermedad.
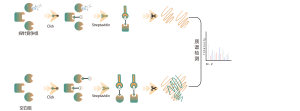
Chomix tiene una amplia experiencia en la identificación de modificaciones de cisteína, como la persulfidación de cisteína. Utilizando de manera innovadora sondas de cisteína universales basadas en la diferencia en pKa entre -SH y -SSH, ajustamos el pH para reducir la interferencia de fondo de -SH, lo que permite que las sondas marquen predominantemente -SSH y, por lo tanto, identifiquen de manera efectiva los sitios de sulfenilación.
Chomix posee tecnología avanzada de espectrometría de masas capaz de resolver de forma directa y precisa varios tipos de modificaciones postraduccionales de proteínas y sus sitios específicos. A través de la integración inteligente de técnicas de separación y enriquecimiento con etiquetado de isótopos y otros métodos avanzados, permitimos análisis cualitativos y cuantitativos de alto rendimiento a gran escala de diversas modificaciones, brindando un sólido soporte técnico para la investigación en profundidad sobre modificaciones postraduccionales de proteínas.

Nuestras ventajas
1. Experiencia profesional: con amplia experiencia y publicaciones en revistas líderes, ofrecemos servicios personalizados para obtener resultados óptimos.
2. Gestión de calidad rigurosa: Nuestros sistemas de calidad maduros cumplen con los estándares ISO9001, lo que garantiza informes confiables.
3. Servicio integral: desde el diseño de la sonda hasta el análisis bioinformático, brindamos consultas todo en uno hasta la entrega, con actualizaciones oportunas del progreso.
4. Equipo avanzado: equipados con espectrómetros de masas de última generación como Thermo Fisher Orbitrap Exploris 480 y Bruker timsTOF, apoyamos investigaciones innovadoras.
Nuestro Servicio
| Proyecto | Análisis ómico de modificaciones postraduccionales de cisteína |
| Muestra | Proteína pura, lisado celular, células vivas, tejido enfermo, sangre, bacterias, tejido vegetal. |
| Plataforma de hardware | Pulverizador de células ultrasónico sin contacto, sistema de imágenes ChemiDoc MP, espectrómetro de masas Orbitrap Fusion Lumos Tribrid/Orbitrap Exploris 480/Q Exactive HF-X/timsTOF Pro 2 |
| Duración del proyecto | 4-8 semanas |
| Entregables | Informe del proyecto (incluidos procedimientos experimentales, cuadros de análisis de datos, resultados de análisis bioinformáticos) |
| Precio | Haga clic para consultar |
Estudio de caso
La tiolación se refiere al acoplamiento de un grupo tiol (-SSH) a residuos de cisteína en proteínas, mediado por sulfuro de hidrógeno (H2S). Para investigar más a fondo este proceso, se pueden extraer proteomas completos de muestras de células o tejidos y etiquetarlos mediante un método de sonda química (sonda específica de cisteína). A diferencia de la interferencia de tiol, este método permite un etiquetado eficaz de los grupos tiol ajustando con precisión el pH. Posteriormente, con la ayuda de espectrometría de masas de alta resolución, los investigadores pueden identificar con precisión los sitios de tiolación, aclarando así aún más el importante papel de esta modificación postraduccional in vivo.
Utilizando modelos de células HeLa, primero se extrajo todo el proteoma. Posteriormente, el modelado con NaHS y ajuste de pH permitió un etiquetado preciso de los grupos tiol mediante una sonda de cisteína universal. A través de una serie de pasos que incluyen enriquecimiento, digestión enzimática y detección espectrométrica de masas, se identificaron 180 péptidos que contienen modificaciones -SSH, junto con 120 proteínas relacionadas, incluidos los sitios de tiolación informados GAPDH_C152 y C247.

Aquí están los espectros MS/MS de péptidos con modificaciones -SSH: