Plataforma Técnica
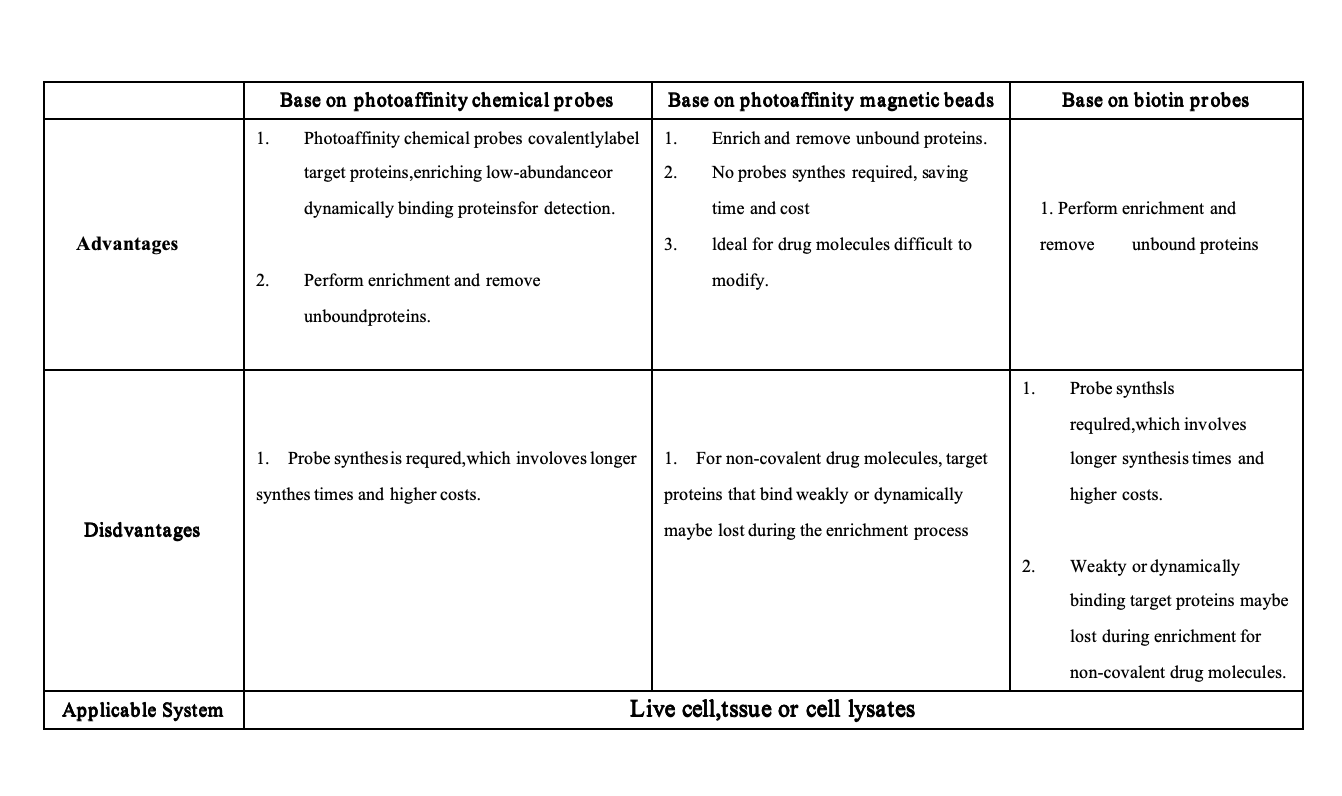
La quimioproteómica ha avanzado en el descubrimiento de objetivos farmacológicos, especialmente con plataformas basadas en sondas químicas. Sin embargo, desafíos como la síntesis compleja, el bajo rendimiento, el alto costo y el SAR desconocido de las moléculas de fármacos obstaculizan el progreso.
La plataforma de perlas magnéticas de fotoafinidad aborda estos problemas inmovilizando moléculas activas del fármaco en perlas magnéticas funcionales mediante iluminación UV, lo que elimina la necesidad de diseñar sondas químicas. Esto asegura una unión específica entre el fármaco y su proteína diana. Después de la incubación con el proteoma, las perlas enriquecen y aíslan las proteínas objetivo del fármaco, que luego se analizan mediante inmunotransferencia y espectrometría de masas.
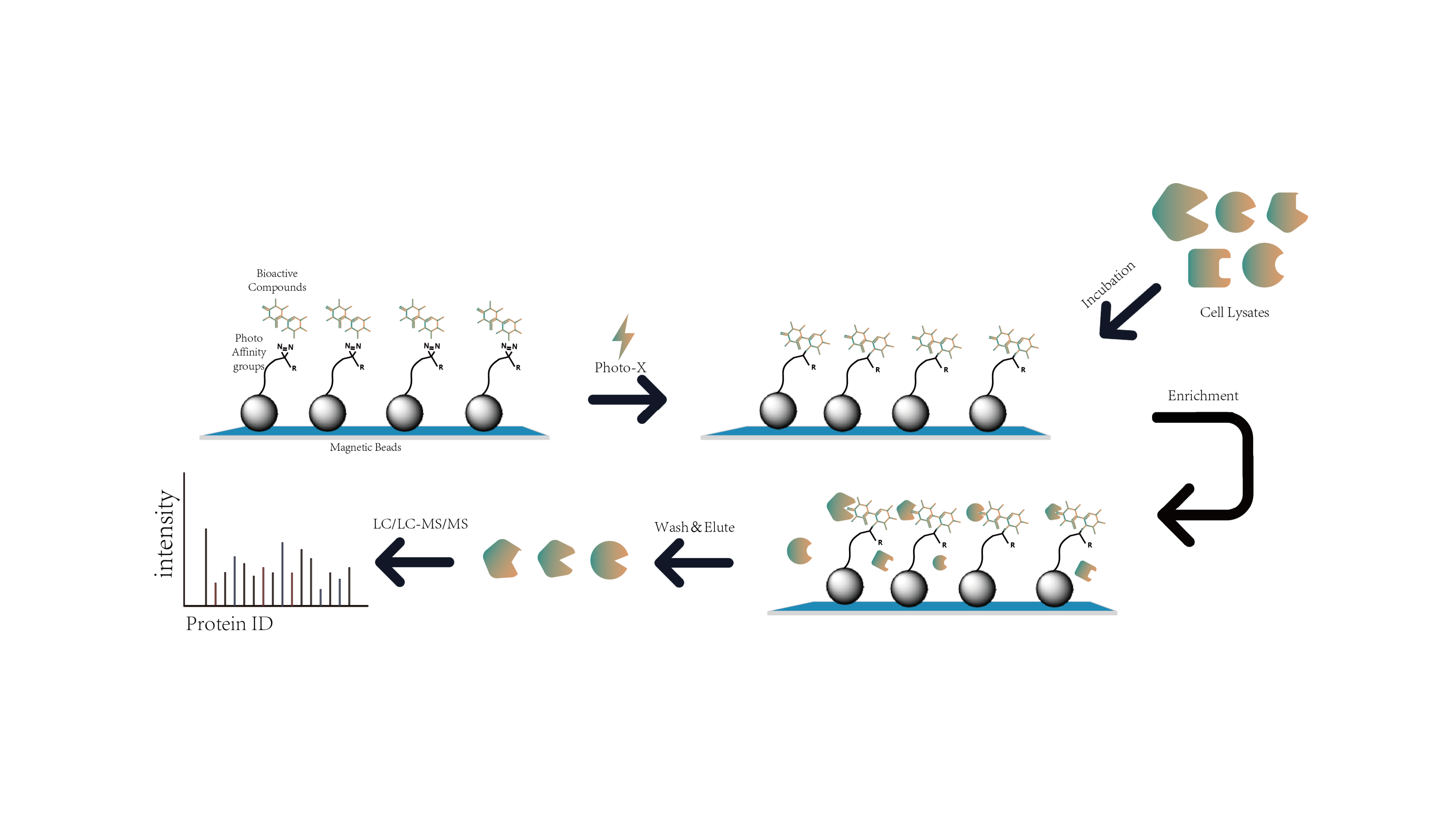
Características de la plataforma
Estudio de caso
Para validar los objetivos de la estaurosporina (Stau), la inmovilizamos sobre la superficie de perlas magnéticas funcionales modificadas por fotoafinidad (Stau-beads). Posteriormente, incubamos las perlas Stau con todo el proteoma, utilizando perlas Fmoc como grupo de control. Los resultados de la transferencia Western (WB) resultantes se muestran en la siguiente figura, lo que indica que Stau-beads enriqueció efectivamente la proteína diana FECH (una diana positiva conocida).
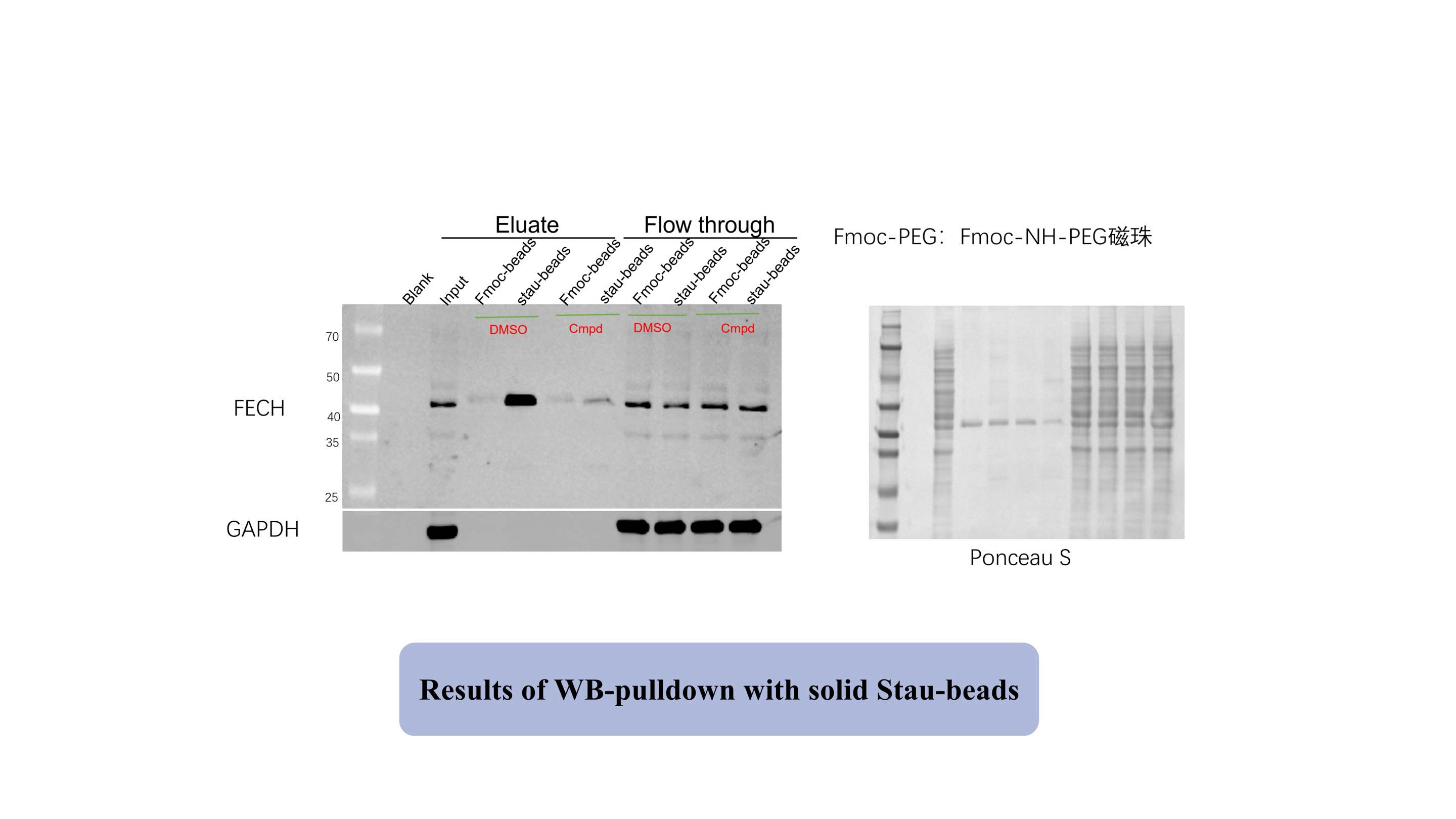
A continuación, sometimos las proteínas enriquecidas y separadas utilizando perlas Fmoc y perlas Stau a digestión enzimática y análisis de espectrometría de masas. Comparamos cuantitativamente las diferencias de intensidad de las proteínas entre el grupo experimental (Stau-beads) y el grupo de control (Fmoc-beads). Los resultados demostraron que todas las proteínas diana positivas conocidas se enriquecieron significativamente en el grupo de Stau-beads, lo que confirma la eficacia del método.