
Productos
Descubrimiento quimioproteómico de nuevas estructuras principales para objetivos no farmacológicos
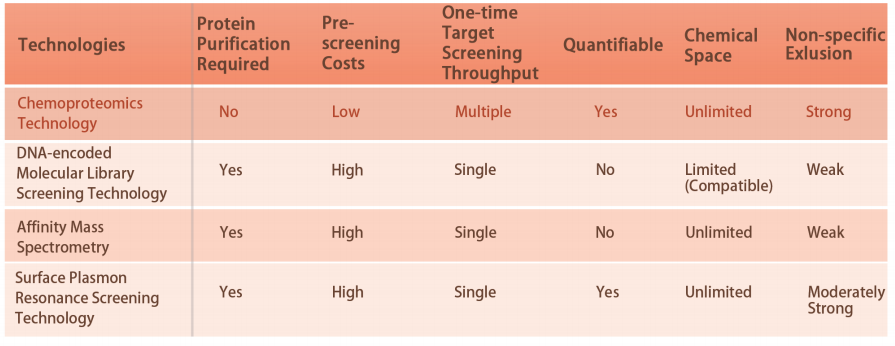
Antecedentes técnicos
Actualmente, sólo ~800 proteínas han sido atacadas por medicamentos aprobados por la FDA, y una gran cantidad de objetivos relacionados con enfermedades son "no farmacológicos". Porque, en la actualidad, la mayoría de las tecnologías se basan en proteínas purificadas. La llegada de la quimioproteómica ha revolucionado el descubrimiento de fármacos, desde proteínas purificadas hasta células vivas. Es capaz de analizar cuantitativamente las interacciones entre pequeñas moléculas y proteínas a escala del proteoma humano. Ahora se ha demostrado en lisados celulares y células vivas el descubrimiento de estructuras covalentes contra residuos de aminoácidos específicos de proteínas dianas, como cisteína, lisina, metionina y tirosina. ChomiX aprovechará su propia plataforma de quimioproteómica para romper rápidamente las barreras de los objetivos "no farmacológicos".

Ventajas técnicas
Características técnicas de la plataforma
La plataforma DIA-ABPP está diseñada para descubrir aglutinantes covalentes que atacan objetivos proteicos a través de reacciones covalentes con el grupo tiol de los residuos de cisteína. Una vez que los residuos de cisteína activos de las proteínas son ocupados preferentemente por moléculas covalentes, se competirá con la etiqueta de la sonda universal que reacciona específicamente con el grupo tiol. En combinación con técnicas de proteómica cuantitativa basadas en DIA, se podrían cuantificar las intensidades de los péptidos marcados con sonda entre la molécula covalente y el grupo de control. Estas diferencias de señal representan las tasas de ocupación de moléculas covalentes frente a sus proteínas de unión. A diferencia de las estrategias tradicionales de detección de un solo objetivo, la plataforma DIA-ABPP permite el análisis cuantitativo de las interacciones entre fragmentos de electrófilos y casi todas las proteínas en células vivas con la resolución de residuos de aminoácidos, lo que mejora en gran medida la eficiencia y reduce el riesgo para el proyecto de descubrimiento de estructuras principales de alto rendimiento. .

Flujo de trabajo de detección de compuestos de plomo covalente
Característica 1

Nuestra biblioteca de moléculas similares a fármacos contiene una variedad de grupos reactivos (ojivas) caracterizados por una reactividad electrofílica leve, como acrilamida, cloroacetamida y alquinamida. Estas moléculas presentan farmacóforos estructuralmente diversos que se ajustan a la Regla de Cinco de Lipinski.
Característica 2

Actualmente, la biblioteca de dianas proteicas capturadas por la sonda química específica de tiol cubre 39962 sitios de cisteína de 12421 proteínas, incluidas quinasas, fosfatasas, ligasas y factores de transcripción. La biblioteca se actualiza continuamente, lo que garantiza el acceso a la información más reciente sobre objetivos y sitios específicos. La información detallada sobre objetivos y sitios específicos está disponible a través del siguiente enlace.
Característica 3

En un único experimento de detección, la plataforma puede cuantificar la participación objetivo de moléculas pequeñas (A2-H6) contra todas las proteínas marcadas en todo el proteoma. La figura anterior muestra la ocupación del sitio de objetivos clínicamente importantes seleccionados por moléculas covalentes. Cuanto más oscuro es el color, mayor es la ocupación de moléculas en las bolsas de unión, incluidos los sitios ortostéricos y alostéricos (el asterisco indica que la tasa de ocupación es superior al 80%). De este modo, la afinidad y selectividad de cada molécula se pueden evaluar simultáneamente para la posterior optimización de la estructura.




