[Financiamiento nacional de proyectos clave] Desentrañar las proteínas de unión a metales: avances en METAL-TPP e innovaciones en el descubrimiento de fármacos
Las proteínas fijadoras de metales son componentes cruciales que forman complejos estables con iones metálicos y desempeñan diversas funciones vitales en los organismos vivos, incluida la señalización celular, la catalización de reacciones bioquímicas y el mantenimiento de la homeostasis de los iones metálicos. Su desregulación está asociada con enfermedades como el cáncer, trastornos neurológicos y enfermedades metabólicas. Comprender su papel en la patogénesis de la enfermedad es fundamental para el diagnóstico y el tratamiento. Además, las proteínas de unión a metales son objetivos importantes en el desarrollo de fármacos, ya que muchos fármacos interactúan con ellas para ejercer efectos terapéuticos. En este estudio, los investigadores introdujeron METAL-TPP, un método proteómico químico de última generación. Combinando el análisis proteómico cuantitativo de termoestabilidad (TPP) con la identificación de proteínas de unión a metales, METAL-TPP permite una detección eficiente y precisa de proteínas de unión a metales. En particular, regula la termoestabilidad de las proteínas mediante una variedad de quelantes metálicos, lo que facilita la identificación precisa en proteínas puras y lisados celulares. Este enfoque innovador ofrece nuevos conocimientos sobre la función y los mecanismos de las proteínas de unión a metales, lo que ayuda a la investigación biológica, la comprensión de las enfermedades y el desarrollo de fármacos. Keloxi Biology proporciona ABPP, TPP y otros servicios técnicos avanzados en I+D farmacéutico, apoyando a los investigadores en la exploración de mecanismos farmacológicos y el avance de nuevos procesos de desarrollo de fármacos.

Proceso experimental
1. Se identificaron diecisiete posibles proteínas de unión a metales utilizando METAL-TPP.
Inicialmente, los investigadores evaluaron la eficacia de la quelación de metales de amplio espectro utilizando EDTA en proteínas puras y lisados celulares. Observaron que METAL-TPP detectó eficazmente reducciones en la estabilidad térmica de las proteínas de unión a metales. Posteriormente, se realizó un análisis sistemático de proteínas de origen humano utilizando METAL-TPP, identificando 125 proteínas que exhibían una termoestabilidad reducida. Entre ellas, 102 eran proteínas de unión a metales conocidas previamente. Además, se descubrieron 17 posibles proteínas de unión a metales sin anotación funcional previa, lo que ofrece nuevos conocimientos sobre el papel de las proteínas de unión a metales.
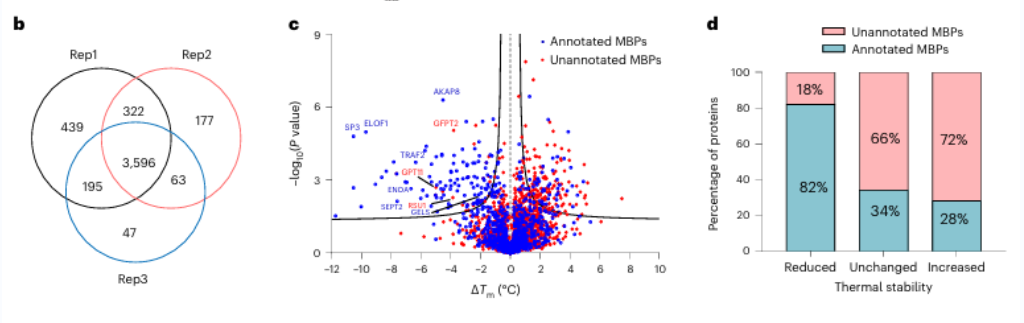
2. El efecto de los iones de zinc sobre la posible proteína de unión a metales GFPT2.
Entre estas 17 posibles proteínas de unión a metales, los investigadores optaron por realizar una validación bioquímica en profundidad de la proteína GFPT2. GFPT1/2 actúa como la primera enzima limitante de la velocidad en la vía de biosíntesis de hexosas, ayudando en la generación de una sustancia llamada UDP-GlcNAc. Los investigadores confirmaron a nivel celular que los iones de zinc interactúan con GFPT2, inhibiendo su actividad. Además, observaron que la presencia de iones de zinc conduce a una reducción significativa en los niveles de UDP-GlcNAc, lo que indica que los iones de zinc regulan la vía de biosíntesis de hexosa al inhibir la actividad de GFPT2. Curiosamente, los iones de zinc exhiben una selectividad diferente para inhibir las actividades de GFPT2 y GFPT1, lo que sugiere la presencia de un nuevo mecanismo regulador.
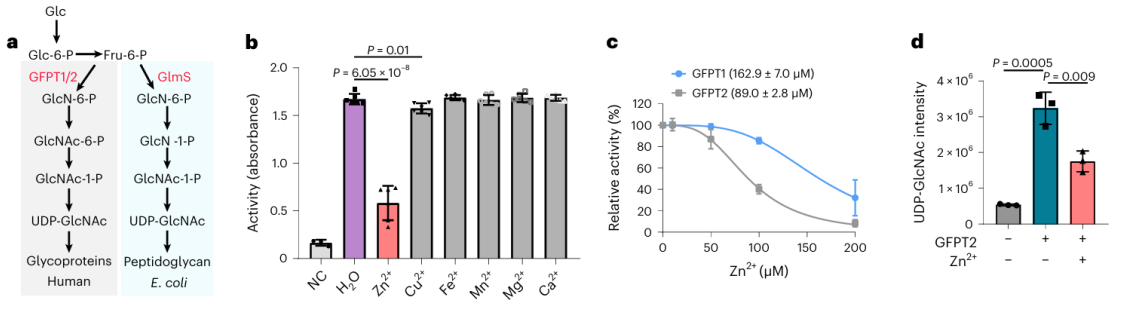
3. Descifrar el mecanismo molecular de los iones de zinc sobre la actividad de la enzima GFPT2 y GLMS.
Los investigadores aislaron el homólogo de la proteína GFPT2 de E. coli y procedieron con una serie de experimentos bioquímicos y análisis de la estructura cristalina. Los hallazgos revelaron que la proteína GLMS tiene la capacidad de unirse a iones de zinc y, en particular, esta unión tiene lugar cerca de la región de unión al sustrato. Esto sugiere un escenario potencial en el que los iones de zinc podrían competir por la unión en el sitio activo de GLMS y GFPT2, o dificultar la actividad de ambas enzimas formando enlaces de coordinación con sus sitios activos.

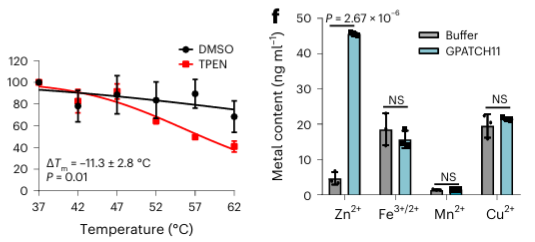
4.El quelante de metales TPEN puede reconocer específicamente las proteínas de unión a iones de zinc.
Por último, los investigadores ampliaron la capacidad de METAL-TPP para identificar proteínas de unión a metales en proteínas humanas utilizando el quelante de metales TPEN. Los resultados experimentales revelaron que entre las 150 proteínas con estabilidad térmica reducida, 110 (73%) eran proteínas de unión a metales conocidas, lo que indica que TPEN, al igual que EDTA, puede reconocer específicamente proteínas de unión a metales. Entre estas, 95 (86%) de las proteínas de unión a metales conocidas eran proteínas de unión a iones de zinc, mientras que sólo el 41% de las proteínas con estabilidad térmica reducida causada por EDTA eran proteínas de unión a iones de zinc, lo que sugiere la preferencia de TPEN por identificar iones de zinc. -proteínas de unión.
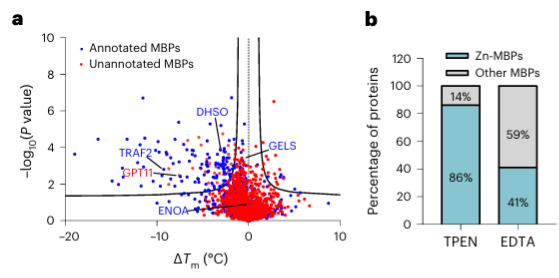
Entre las 40 posibles proteínas de unión a metales identificadas, los autores seleccionaron una proteína objetivo, GPATCH11, para la validación bioquímica preliminar y descubrieron que esta proteína es una proteína de unión a iones de zinc.
5. Comparación de la capacidad de reconocimiento de dos quelantes de metales en METAL-TPP.
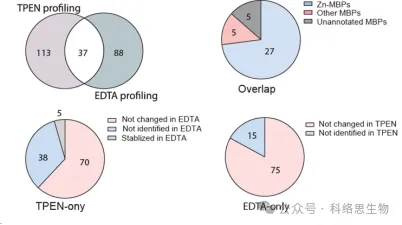
Los investigadores también compararon la capacidad de dos quelantes de metales, TPEN y EDTA, para identificar proteínas con estabilidad térmica reducida en datos proteómicos de METAL-TPP. Descubrieron que entre las 37 proteínas identificadas por ambos quelantes, se sabía que 27 se unían al zinc, 5 se unían a otros metales y 5 no estaban previamente anotadas como proteínas de unión a metales. Para las proteínas cuya estabilidad térmica disminuyó con un quelante y permaneció sin cambios o aumentó con el otro, los investigadores sugirieron dos posibles razones para la diferencia en el rango de identificación por METAL-TPP. En primer lugar, cada quelante puede actuar como ligando de unión en algunas proteínas, haciéndolas más estables y contrarrestando el efecto desestabilizador causado por la unión del metal. En segundo lugar, debido a las diferentes estructuras moleculares, los dos quelantes también tienen una solubilidad en agua muy diferente. Por lo tanto, se pueden realizar futuros estudios de METAL-TPP utilizando otros quelantes con estructuras moleculares únicas para explorar de manera más completa el alcance del metaloproteoma.
En general, este estudio ha introducido un método novedoso, METAL-TPP, que sirve como una herramienta potente para realizar investigaciones proteómicas de unión de metales. Gracias a este enfoque, los investigadores identificaron sistemáticamente proteínas de unión a metales y dilucidaron su papel en las funciones biológicas y la patogénesis. Este esfuerzo no sólo establece bases de datos importantes, sino que también proporciona información valiosa para comprender las funciones bioquímicas y el potencial de desarrollo de fármacos de las proteínas de unión a metales, fomentando así más investigaciones en campos relacionados.
Referencia:,https://www.nature.com/articles/s41589-024-01563-y.

