Productos
Modificaciones postraduccionales de serina/treonina
Las modificaciones postraduccionales (PTM) de serina y treonina se refieren a las modificaciones químicas que sufren las proteínas después de la síntesis, siendo la fosforilación y la glicosilación las formas más comunes de modificación. Los PTM en residuos de serina y treonina incluyen principalmente fosforilación y O-glicosilación. Después de la modificación, estos residuos de aminoácidos pueden alterar significativamente la actividad, la estabilidad y las capacidades de interacción de la proteína, desempeñando así funciones cruciales en la transducción de señales celulares, la regulación metabólica y otros procesos biológicos clave. Los estudios en profundidad de estas modificaciones ayudan a revelar los mecanismos moleculares detrás de las actividades vitales y pueden proporcionar nuevos objetivos para el tratamiento de enfermedades. Por lo tanto, las PTM de serina y treonina tienen una importancia indispensable tanto en la investigación biológica fundamental como en las aplicaciones clínicas.
Chomix posee tecnología avanzada de espectrometría de masas capaz de analizar de forma directa y precisa varios tipos de modificaciones postraduccionales de proteínas y sus sitios específicos. Al combinar inteligentemente técnicas de enriquecimiento por separación y etiquetado de isótopos, se pueden lograr análisis cualitativos y cuantitativos a gran escala y de alto rendimiento de diversas modificaciones, lo que proporciona un sólido soporte técnico para una investigación en profundidad sobre las modificaciones postraduccionales de proteínas.
Plataforma Técnica (O-glicosilación)
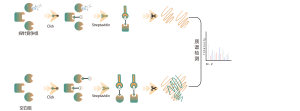
La glicosilación ligada a O es un proceso bioquímico que transfiere cadenas de azúcar a los átomos de oxígeno de los residuos de serina y treonina en cadenas peptídicas. Utilizando reactivos UDP-GalNAz y Y289L GalT1, estos agentes pueden marcar moléculas de azúcar en sitios de glicosilación con un grupo -N3. Los pasos posteriores que involucran química de clic, digestión enzimática, enriquecimiento y espectrometría de masas de alta resolución permiten la identificación precisa de los sitios de O-glicosilación, revelando así el papel crucial de esta modificación postraduccional en los organismos.

Nuestras ventajas
1. Experiencia profesional: con amplia experiencia y publicaciones en revistas líderes, ofrecemos servicios personalizados para obtener resultados óptimos.
2. Gestión de calidad rigurosa: Nuestros sistemas de calidad maduros cumplen con los estándares ISO9001, lo que garantiza informes confiables.
3. Servicio integral: desde el diseño de la sonda hasta el análisis bioinformático, brindamos consultas todo en uno hasta la entrega, con actualizaciones oportunas del progreso.
4. Equipo avanzado: equipados con espectrómetros de masas de última generación como Thermo Fisher Orbitrap Exploris 480 y Bruker timsTOF, apoyamos investigaciones innovadoras.
Nuestro Servicio
| Proyecto | Modificaciones postraduccionales de serina/treonina basadas en espectrometría de masas de alta resolución |
| Muestra | Lisado, células vivas, muestras de tejido |
| Plataforma de hardware | VanquishNeo UPLC junto con el espectrómetro de masas Orbitrap Exploris 480 (Thermo Fisher Scientific); UPLC EASY-nLC1200 acoplado con espectrómetro de masas Q Exactive HF-X (Thermo Fisher Scientific) |
| Duración del proyecto | 4-8 semanas |
| Entregables | Informe del proyecto (incluidas imágenes de gel, información del sitio, etc.) |
| Precio | Haga clic para consultar |
Estudio de caso
Objetivo del proyecto: El objetivo de este proyecto es realizar un análisis proteómico químico en profundidad de la modificación postraduccional de O-GlcNAcilación utilizando tecnología de espectrometría de masas.
Solución: Empleamos un enfoque combinado de etiquetado metabólico y espectrometría de masas para realizar un análisis cualitativo preciso y completo de los sitios de O-glicosilación. En el proceso experimental, primero determinamos la cantidad de enzima Y289L GalT1 utilizando tecnología de gel de fluorescencia, seguido de un análisis espectrométrico de masas en condiciones experimentales rigurosamente definidas. A través de dos rondas de experimentos repetidos, se identificaron un total de 36 sitios de glicosilación confiables. Se presenta un ejemplo de un espectro MS2 típico.