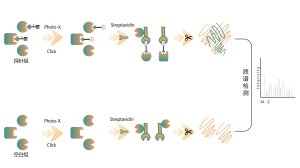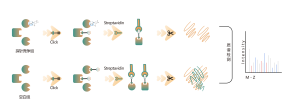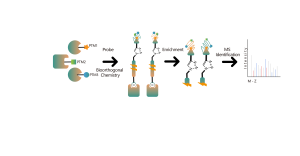Productos
Interacciones pequeñas molécula-proteína
Las proteínas, como participantes y ejecutoras directas de las actividades vitales, representan objetivos cruciales para la terapia de enfermedades. Los fármacos de molécula pequeña (compuestos orgánicos típicamente con un peso molecular inferior a 1000 Da) ejercen efectos terapéuticos eficaces al modular finamente las actividades, abundancias e interacciones de las proteínas. Los fármacos de molécula pequeña comunes incluyen productos naturales y sus derivados (p. ej., monómeros de hierbas), así como fármacos sintetizados químicamente. Al ingresar al cuerpo humano, estos medicamentos ejercen sus efectos terapéuticos uniéndose a proteínas diana dentro de las células o externamente. Por lo tanto, comprender cómo se unen los fármacos de moléculas pequeñas a las proteínas diana es particularmente crucial en el desarrollo de fármacos, especialmente en entornos fisiológicos complejos como células vivas, sangre y tejidos enfermos. El análisis en profundidad de la interacción entre fármacos de molécula pequeña y proteínas no sólo permite la identificación precisa de los objetivos de los fármacos, sino que también revela los mecanismos moleculares de acción de los fármacos y los posibles efectos fuera del objetivo. Además, promete descubrir nuevos objetivos terapéuticos, proporcionando así estrategias más ricas para el tratamiento de enfermedades.
Además de los fármacos de molécula pequeña, los metabolitos endógenos de molécula pequeña dentro de los organismos, como el ATP, el colesterol, los ácidos biliares, el ácido araquidónico y el ácido retinoico, participan en la regulación de muchas vías de señalización importantes y actividades proteicas al interactuar con proteínas, incluidas las proteínas de transporte y las proteínas de membrana. receptores, factores de transcripción y enzimas metabólicas. En los últimos años, la interacción entre los metabolitos de la microbiota intestinal y las células huésped se ha convertido en un foco de investigación. Por lo tanto, la investigación exhaustiva y el mapeo de las redes de interacción entre metabolitos y proteínas en entornos celulares, especialmente en estados de enfermedad, son de gran importancia para comprender los procesos vitales y tratar enfermedades.
La proteómica química, como una rama importante de la biología química, se ha empleado ampliamente en la investigación de la función de las proteínas, la identificación de objetivos de fármacos de moléculas pequeñas y la detección de nuevas estructuras de fármacos. Esta plataforma tecnológica utiliza una variedad de sondas químicas funcionalmente diversas, combinadas con proteómica, con el objetivo de dilucidar los mecanismos de interacción entre moléculas pequeñas y proteínas en condiciones fisiológicas (como células vivas, sangre, tejidos, etc.). Vale la pena mencionar que, en comparación con los sistemas de proteínas purificadas, el uso de sistemas de células vivas es una característica importante de la proteómica química. Permite una representación realista de la distribución de objetivos para fármacos de molécula pequeña, metabolitos endógenos, etc., dentro de proteomas complejos, incluso hasta el nivel de los sitios de residuos de aminoácidos.
Chomix ofrece servicios de análisis profesionales para interacciones molécula-proteína pequeñas, lo que le permite profundizar en posibles objetivos farmacológicos y mejorar su comprensión de los mecanismos moleculares de los fármacos y sus posibles efectos secundarios. Nuestro equipo de expertos posee una amplia experiencia en la investigación de proteómica química y seleccionará los métodos más adecuados y confiables para usted, eliminando cualquier preocupación sobre desafíos técnicos y facilitando el avance de su investigación sin esfuerzo.

Servicio Técnico
1. Identificación de objetivos directos para fármacos de molécula pequeña no covalentes
La mayoría de los fármacos de molécula pequeña interactúan con proteínas diana mediante unión no covalente, formando interacciones dinámicas y reversibles con residuos de aminoácidos en bolsas de unión mediante enlaces de hidrógeno, apilamiento π-π, interacciones hidrofóbicas, etc. Por lo tanto, el enriquecimiento estable y el aislamiento de proteínas unidas por Los fármacos de molécula pequeña no covalentes procedentes de proteomas complejos plantean desafíos importantes. Para solucionar este problema, Chomix ha desarrollado una plataforma de identificación de objetivos de proteómica química basada en fotosondas. Esta plataforma captura con precisión la unión dinámica entre moléculas pequeñas y proteínas en células vivas y logra la separación y el enriquecimiento, identificando así de manera integral objetivos directos para fármacos de moléculas pequeñas no covalentes a nivel proteómico.
2. Identificación de bolsas de unión para fármacos de molécula pequeña no covalentes
En el proceso de desarrollo de fármacos de molécula pequeña, es crucial determinar primero la información de unión entre el fármaco y la proteína, y luego especificar a qué bolsillo particular de la superficie de la proteína se une el fármaco y cómo se une. Esta información es esencial para la posterior optimización de la estructura del fármaco. Además de los enfoques clásicos de biología estructural, Chomix también ha desarrollado una plataforma tecnológica avanzada de proteómica química basada en espectrometría de masas de alta resolución. Esta plataforma puede identificar péptidos de unión para fármacos de molécula pequeña no covalentes a nivel proteico e incluso celular, ayudando así a abordar esta cuestión crítica en el desarrollo temprano de fármacos.
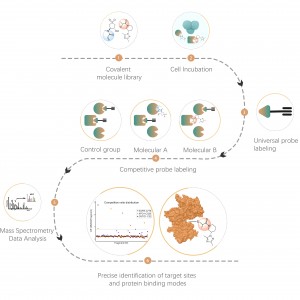
3. Análisis cuantitativo de ocupación y selectividad de objetivos farmacológicos de moléculas pequeñas covalentes
Los medicamentos covalentes se refieren a medicamentos que forman enlaces covalentes estables con residuos de aminoácidos en las bolsas de unión de las proteínas diana, como los que se unen a cisteína, lisina, serina, etc. Los medicamentos covalentes comunes incluyen aspirina, osimertinib, zebularina, así como productos naturales como artemisinina y artesunato. En las células vivas, los fármacos covalentes pueden unirse de forma estable y ocupar residuos de aminoácidos específicos en las proteínas diana. Aprovechando esta característica, Chomix ha desarrollado con éxito una plataforma de proteómica química basada en una sonda universal. Esta plataforma permite el análisis cuantitativo de la ocupación del sitio objetivo para fármacos covalentes de molécula pequeña, hasta el nivel de residuos de aminoácidos. Además, al analizar la información de ocupación de más de 10.000 sitios de residuos de aminoácidos, puede determinar la selectividad del objetivo en diferentes concentraciones de fármaco, lo que proporciona una guía poderosa para el desarrollo temprano de fármacos.
4. Identificación y análisis de selectividad de objetivos degradadores de proteínas.
Como nuevo tipo de fármaco, las quimeras dirigidas a la proteólisis (PROTAC) se diferencian de los inhibidores o activadores de moléculas pequeñas tradicionales. Subvierten el concepto convencional de desarrollo "impulsado por la ocupación" en la química medicinal al utilizar el sistema endógeno de ubiquitina-proteasoma (UPS) para degradar específicamente las proteínas que causan enfermedades, especialmente aquellas consideradas objetivos "no farmacológicos". Por lo tanto, la identificación cuantitativa de los objetivos de los fármacos degradadores de proteínas y su selectividad a nivel del proteoma completo es crucial para el desarrollo temprano de dichos fármacos. Chomix ha desarrollado con éxito varias plataformas tecnológicas de proteómica química cuantitativa capaces de analizar cualitativa y cuantitativamente más de 5000 proteínas en líneas celulares individuales, proporcionando un análisis completo y en profundidad de la selectividad objetivo.