Revelando el misterio de la pequeña molécula WA: arrojando luz sobre la regulación de la enzima PHGDH y allanando el camino para nuevas terapias contra el cáncer
La serina, un aminoácido indispensable, cumple varias funciones biológicas cruciales dentro de los organismos vivos. No sólo sirve como componente fundamental en la síntesis de proteínas sino que también participa en la regulación de numerosas vías metabólicas, incluida la síntesis de nucleótidos, el metabolismo de la metionina y las funciones antioxidantes. Entre estas vías, la fosfopiruvato deshidrogenasa (PHGDH) tiene una importancia fundamental ya que cataliza el paso inicial de la vía de síntesis de serina, convirtiendo el 3-fosfoglicerato en 3-fosfohidroxipiruvato. Dado su papel central en el metabolismo de la serina, cualquier aberración en la función de PHGDH está estrechamente relacionada con la aparición y progresión de numerosas enfermedades, en particular el cáncer.
Este artículo presenta un enfoque innovador que utiliza proteómica química y técnicas de análisis fenotípico para identificar un compuesto capaz de inhibir covalentemente la PHGDH. Si bien la mayoría de los inhibidores de PHGDH suelen ser de naturaleza competitiva, los autores presentan la withangulatina A (WA), una pequeña molécula natural, como un nuevo inhibidor covalente de PHGDH. WA emerge como un compuesto líder prometedor para el desarrollo de inhibidores de PHGDH. Además, WA sirve como una sonda valiosa para investigar la funcionalidad de PHGDH y la vía de síntesis de serina (SSP). Aprovechando este inhibidor, los investigadores obtienen conocimientos más profundos sobre los mecanismos reguladores que rigen el metabolismo de la serina, abriendo así vías para explorar posibles modalidades de tratamiento para enfermedades relacionadas, en particular el cáncer.
Este descubrimiento no sólo ofrece direcciones prometedoras para el desarrollo de nuevas estrategias de tratamiento farmacológico, sino que también proporciona información crucial sobre el papel del metabolismo de la serina en la progresión de la enfermedad.
Ruta de investigación
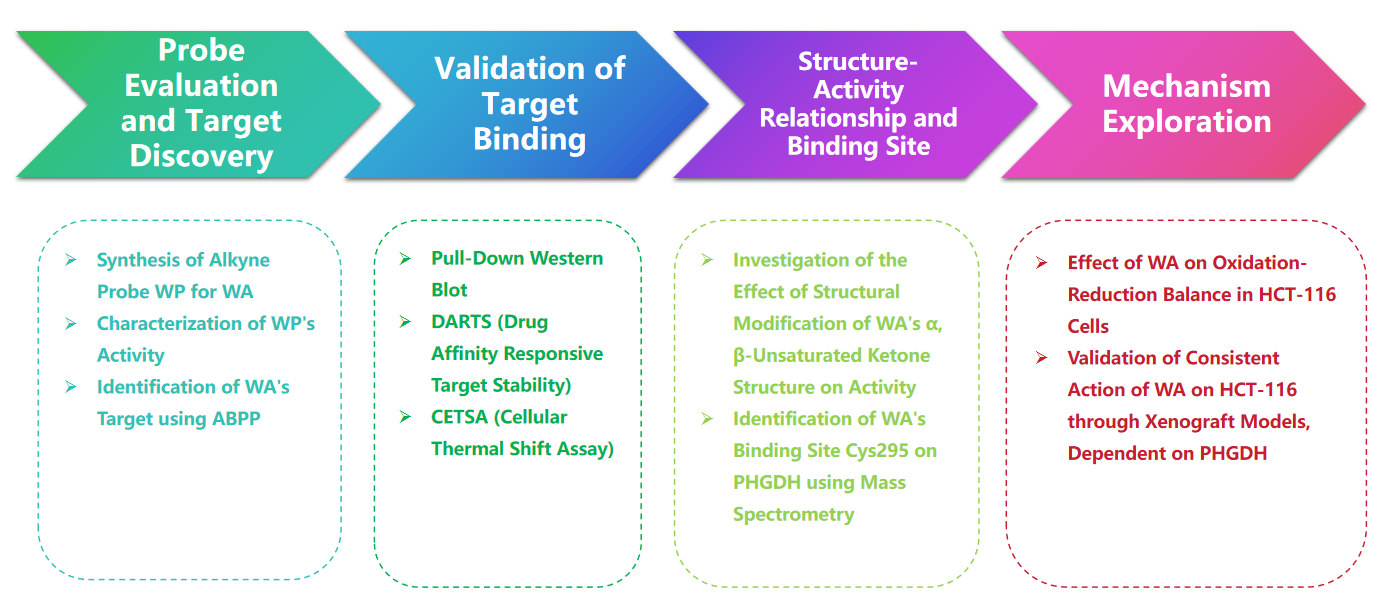
Proceso experimental
1. Comparación de WP y WA en los experimentos de citotoxicidad.
En el estudio, el autor ideó y sintetizó una sonda compuesta denominada WP. Empleando células de cáncer de colon humano (HCT-116) y células de colon normales (NCM460), los autores observaron que WP exhibía una citotoxicidad comparable a la WA. Esto sugiere que la inclusión de marcadores alquinos no alteró significativamente sus efectos citotóxicos. Además, los autores observaron que WA mostraba una citotoxicidad más baja en las células de colon normales pero una citotoxicidad más alta en las células de cáncer de colon, lo que subraya su mayor selectividad hacia las células de cáncer de colon.
Posteriormente, los autores emplearon una estrategia de perfilado de proteínas basado en actividad (ABPP), utilizando la sonda WP en células HCT-116. Este enfoque condujo a la identificación de PHGDH como una proteína diana directa de WA. La validación experimental se llevó a cabo mediante ensayos de extracción de WB, lo que confirmó los hallazgos.
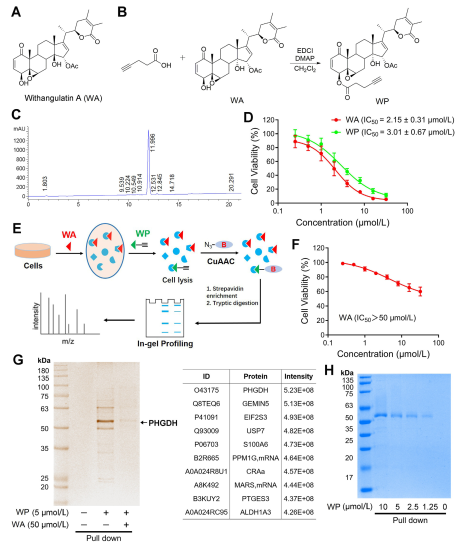
Figura 1: Enfoque de proteómica química para identificar objetivos de withangulatina A.
2. Confirmación de interacción directa entre WA y PHGDH.
Utilizando la tecnología de perfilado de proteínas basado en actividad (ABPP), los autores identificaron PHGDH como un objetivo directo del compuesto WA en células HCT-116. Para validar la interacción entre WA y PHGDH, los autores realizaron experimentos de estabilidad del objetivo sensible a la afinidad de fármacos (DARTS) y ensayo de cambio térmico celular (CETSA). Los resultados demostraron que WA mejoró la estabilidad térmica de PHGDH e inhibió significativamente su actividad. Además, los experimentos de interferometría de biocapa (BLI) proporcionaron una confirmación adicional de la interacción directa entre WA y PHGDH.
Los autores también investigaron la naturaleza irreversible de la unión de WA a PHGDH. Sus experimentos revelaron que PHGDH impidió la unión de WP; sin embargo, la preincubación con soluciones que contienen N-acetilcisteína (NAC) o glutatión (GSH) podría revertir la unión de WP a PHGDH. Estos hallazgos sugieren una unión covalente irreversible entre WA y residuos de cisteína en la proteína PHGDH.
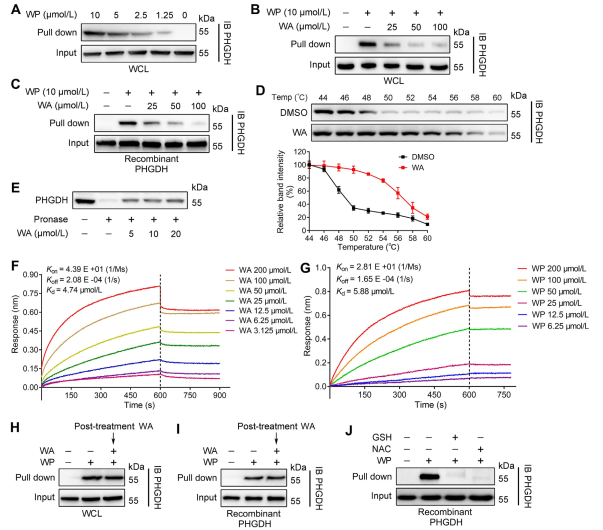
Figura 2: WA se une directamente a PHGDH.
3. WA se une covalentemente a PHGDH a través del resto cetona α - β -insaturado.
Para dilucidar aún más el mecanismo por el cual WA interactúa con PHGDH, los investigadores realizaron experimentos para confirmar la unión covalente de WA a PHGDH a través de su estructura de cetona α-β-insaturada. Inicialmente, los fragmentos de cetona α,β-insaturada de WA se redujeron para producir WA-1 (consulte la Figura 3A de la parte). Los análisis posteriores utilizando los ensayos Cell Counting Kit-8 (CCK-8) y los ensayos de interacción de proteínas desplegables (consulte la Figura 3B) demostraron que el efecto citotóxico de WA dependía de su estructura de cetona α y β-insaturada. Por el contrario, WA-1 no logró prevenir eficazmente la unión de PHGDH a WP (consulte la Figura 3C y D), confirmando así aún más la unión covalente de la cetona β-insaturada a PHGDH (consulte la Figura 3E).
Dado el papel importante de la inhibición o ausencia de PHGDH en el bloqueo de los procesos de la vía de síntesis de serina (SSP) en células tumorales, los autores procedieron a investigar el efecto de WA en la actividad de SSP en células HCT-116 utilizando el marcaje con isótopos estables de glucosa U-13C (consulte a la Figura 3J). Los resultados experimentales revelaron que WA inhibió eficazmente la actividad de SSP en células HCT-116.
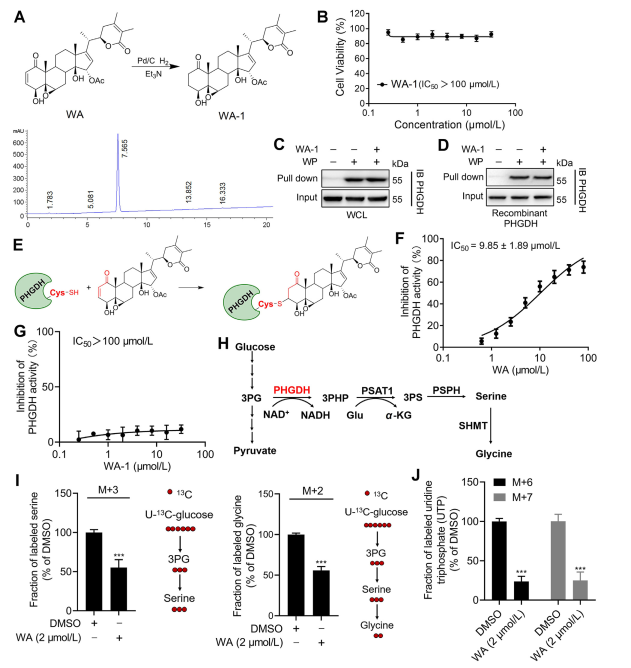
Figura 3: WA se une covalentemente a PHGDH e inhibe la actividad de PHGDH.
4. El residuo Cys295 de PHGDH está unido covalentemente a WA.
Teóricamente, los restos cetonas α y β-insaturados de WA pueden formar un enlace covalente con residuos de cisteína de la proteína. De hecho, los autores observaron una modificación covalente de los residuos Cys295 en PHGDH por WA. Posteriormente, proporcionaron más evidencia de la unión covalente de WA a los residuos Cys295 de PHGDH y demostraron que las mutaciones en Cys295 reducían significativamente la actividad inhibidora de WA en PHGDH. Además, los experimentos de interferometría de biocapa (BLI) no revelaron interacción entre WA y la proteína PHGDH Cys295A recombinante, lo que confirma la unión covalente selectiva de WA a PHGDH.
Además, las simulaciones de dinámica molecular indicaron que WA funciona como un regulador alostérico de PHGDH, y que el residuo Cys295 sirve potencialmente como un nuevo sitio alostérico para PHGDH.
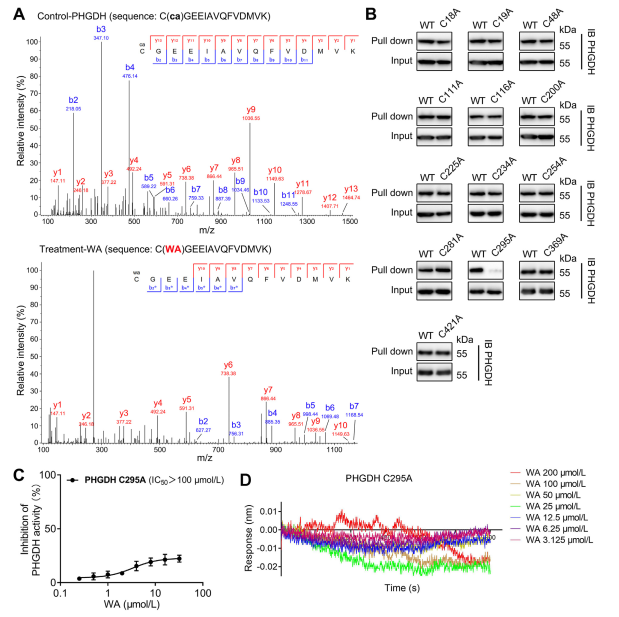
Figura 4. WA se une selectivamente de forma covalente a los residuos Cys295 de PHGDH.
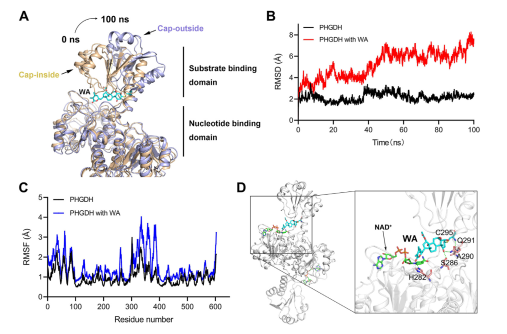
Figura 5: Residuo Cys295 como sitio regulador alostérico de PHGDH
5. El efecto del WA sobre el equilibrio redox en células HCT-116.
La vía de síntesis de serina (SSP) desempeña un papel fundamental en el mantenimiento del equilibrio redox celular al proporcionar precursores para la síntesis de glutatión (GSH) y la producción de NADPH, esenciales para las reacciones redox. Los autores investigaron el impacto del WA en el equilibrio redox en las células HCT-116 y observaron que el WA conducía a mayores niveles de especies reactivas de oxígeno (ROS), reduciendo en consecuencia las proporciones GSH/GSSG y NADPH/NADP+, indicativas de un mayor estrés oxidativo.
El análisis de transferencia Western reveló una expresión elevada de γ H2AX, caspasa3 escindida y PARP escindida, junto con una expresión disminuida de CHK2 y ciclina D1, lo que sugiere la inducción de apoptosis por WA. Además, la pérdida de PHGDH resultó en una mayor producción de ROS, inhibió la proliferación de células HCT-116 y redujo la citotoxicidad de WA en células con baja expresión de PHGDH. Estos hallazgos subrayan el papel de PHGDH en la producción de ROS y la citotoxicidad mediada por WA en células HCT-116.
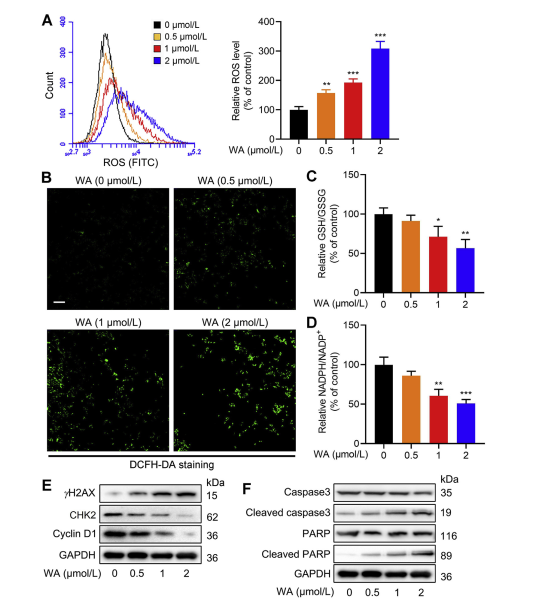
Figura 6: WA aumenta los niveles de ROS intracelulares en células HCT-116
6. Efecto de la proliferación celular en modelos de xenoinjerto.
Para evaluar el impacto de WA en la proliferación de células HCT-116 in vivo, los autores establecieron un modelo de xenoinjerto utilizando células HCT-116. Los resultados revelaron que WA no mostró efectos significativos sobre el peso corporal o la morfología de los órganos, lo que indica una baja toxicidad.
Para investigar más a fondo la selectividad de WA para la inhibición de PHGDH, los autores generaron un modelo de xenoinjerto utilizando células HCT116 knockout (KO) de PHGDH. En este modelo, la ausencia de PHGDH inhibió notablemente la proliferación de células HCT-116 (consulte la Figura 7, AC). Además, la expresión de Ki67, un marcador de proliferación celular, se redujo significativamente en el modelo de xenoinjerto de células PHGDH KO HCT116 (consulte la Figura 7, D).
En particular, en el modelo de xenoinjerto que utiliza células PHGDH KO HCT-116, WA no demostró ningún efecto inhibidor significativo sobre la proliferación celular (consulte la Figura 7, EG), lo que confirma además que el efecto inhibidor de WA en las células HCT-116 dependía de PHGDH.
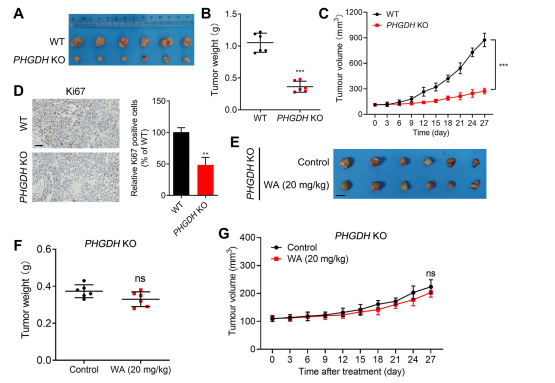
Figura 7: Efecto de WA sobre la proliferación de células PHGDH KO HCT-116 in vivo
Los resultados de este estudio no sólo proporcionan pistas clave para el futuro desarrollo de fármacos anticancerígenos para PHGDH, sino que también aportan nuevas esperanzas y potencial para el desarrollo de nuevos fármacos en el campo de la terapia contra el cáncer.
Referencia:https://doi.org/10.1016/j.apsb.2021.06.008

