L'analyse ABPP révèle un nouveau mécanisme anti-inflammatoire de l'acide itaconique via des interactions protéine-métabolite
L'itaconate, un métabolite endogène crucial pour l'inflammation et la régulation immunitaire, voit son rôle élucidé dans un article conjoint de l'équipe ChomiX Biotech. L'étude a utilisé de manière innovante la technologie ABPP pour révéler que l'itaconate modifie la S-glycosylation des résidus de cystéine sur les enzymes glycolytiques clés, ayant ainsi un impact sur le métabolisme cellulaire. Les chercheurs ont cartographié les interactions protéine-itaconate et ont découvert que l'itaconate se lie et régule directement plusieurs enzymes dans la voie de la glycolyse, affectant ainsi son taux et sa direction. Cette recherche fait progresser nos connaissances sur les mécanismes de contrôle métabolique au cours de l'inflammation liée à la maladie et démontre la force de l'ABPP dans l'exploration de la façon dont les petites molécules modulent les fonctions des protéines. En tant que leader de la protéomique chimique, Corolus BioScience propose des solutions complètes, notamment la conception de sondes, le traitement des échantillons, le criblage à haut débit et l'analyse des données, pour aider ses clients à découvrir des mécanismes de régulation métabolique similaires.
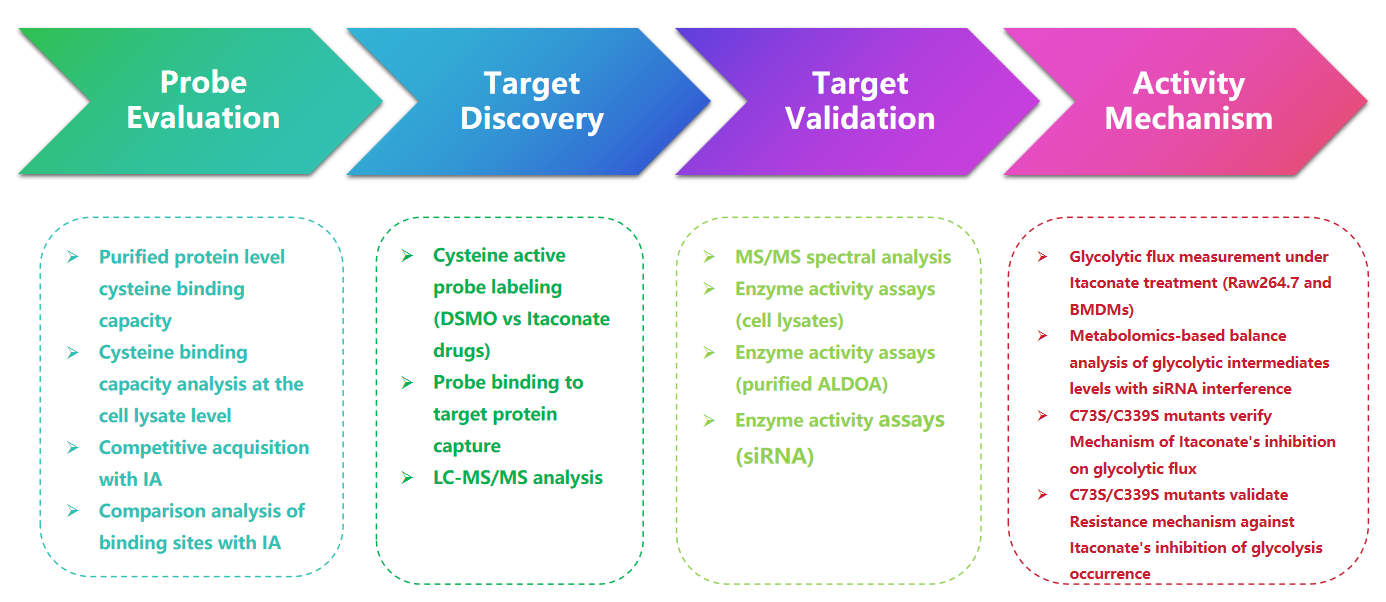
1. Détection des modifications Itaconate avec la sonde 1-OH-Az
Dans cette étude, les auteurs ont utilisé des techniques de profilage avancées pour étudier les résidus de cystéine ciblés par l'itaconate. Ils ont d’abord évalué la sonde 1-OH-Az par électrophorèse sur gel et réalisé des expériences compétitives en utilisant l’IA-alcyne. La validation par spectrométrie de masse a confirmé que le 1-OH-Az marque sélectivement les sites de cystéine, avec 87 % des protéines nouvellement identifiées qui n'étaient pas documentées auparavant comme protéines de liaison au ligand dans DrugBank. Compte tenu des diverses fonctions et de l’importance de ces protéines pour la maladie, la sonde 1-OH-Az peut être utilisée pour identifier les cystéines actives en tant que cibles médicamenteuses potentielles pour de nouveaux traitements.
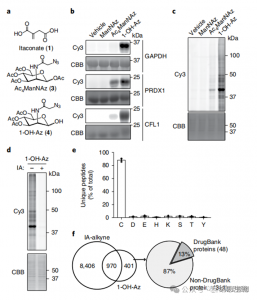
Figure 1 : 1-OH-Az comme sonde d'analyse de cystéine efficace et distinctive pour détecter les modifications de l'itaconate
2. Identification des sites de modification Itaconate à l’aide de techniques de protéomique quantitative
Les chercheurs ont mené des expériences isoTOP-ABPP pour quantifier les résidus de cystéine modifiés par l'itaconate à l'aide de la sonde 1-OH-Az. Après le prétraitement du lysat, une protéomique quantitative assistée par un lieur marquée par un marqueur isotopique a été utilisée pour analyser l'impact de différentes concentrations d'itaconate, en identifiant ses cibles spécifiques. Des expériences comparatives ont également été réalisées en utilisant deux concentrations d'IA-alcyne, qui, tout en montrant une activité et une couverture plus larges, n'ont reconnu que 65 et 50 sites concurrents efficaces. Notamment, le 1-OH-Az a démontré un avantage concurrentiel significativement plus élevé parmi les cystéines co-quantifiées.
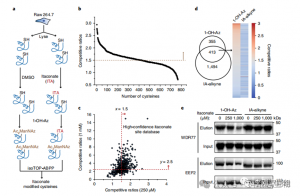
Figure 2 : Analyse protéomique chimique des cystéines modifiées par l'itaconate utilisant l'isoTOP-ABPP compétitif avec le 1-OH-Az
3. L'itaconate modifie et inhibe une enzyme glycolytique clé
L'analyse spectrométrique de masse a révélé que l'itaconate modifie trois enzymes glycolytiques clés : ALDOA, GAPDH et LDHA. La modification endogène de l'itaconate sur Cys73 et Cys339 d'ALDOA a été confirmée dans les cellules Raw264.7 stimulées par le LPS. En raison de leur proximité, les auteurs ont émis l’hypothèse que de telles modifications pourraient influencer l’activité aldolase. En effet, le traitement avec 1 mM d’itaconate a entraîné une réduction de l’activité enzymatique ALDOA sans affecter l’expression des protéines. De plus, les analyses isoTOP-ABPP ont montré que Cys84 sur LDHA et Cys245 sur GAPDH sont également des cibles pour la modification de l'itaconate.

Figure 3 : Itaconate peut modifier et altérer la fonction ALDOA
4. L'itaconate supprime principalement la glycolyse en ciblant l'ALDOA
Pour évaluer le rôle régulateur de l'ITAC dans la glycolyse inflammatoire des macrophages, les auteurs ont surveillé la consommation de glucose et la production de lactate dans les cellules Raw264.7 avant et après la stimulation du LPS, démontrant que l'ITAC diminuait de manière significative les deux, indiquant une suppression de la fonction glycolytique. Pour valider l'effet de l'ITAC sur l'ALDOA et l'inhibition ultérieure de la glycolyse, ils ont neutralisé l'ALDOA endogène à l'aide d'ARNi et ont surexprimé l'ALDOA WT ou double mutant (C73S/C339S) dans des cellules Raw264.7. Comme prévu, l'inactivation d'ALDOA a entraîné une diminution de la consommation de glucose et de la production de lactate, rendant les cellules insensibles au traitement ITAC. La réintroduction de WT ou d'ALDOA mutant a rétabli les niveaux métaboliques dans les cellules non traitées ; cependant, les cellules surexprimant le mutant ALDOA présentaient une sensibilité réduite à l'inhibition glycolytique par rapport au WT. Dosages enzymatiques pour l'activité aldolase alignés sur les états glycolytiques.
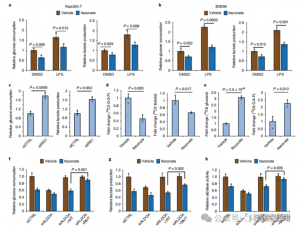
Figure 4 : Itaconate modifie la voie glycolytique en modifiant ALDOA
5. L'inhibition d'ALDOA contribue aux réponses anti-inflammatoires
Ces résultats ont révélé qu'ITAC supprime l'activité de la voie glycolytique en modifiant les résidus de cystéine Cys73 et Cys339 sur ALDOA. Les auteurs ont en outre déduit de l'action anti-inflammatoire connue du fumarate de diméthyle via la modification de la cystéine sur la GAPDH et l'inhibition glycolytique que l'ITAC pourrait également interférer avec la glycolyse pour exercer un effet anti-inflammatoire. L'inactivation d'ALDOA a réduit de manière significative la sécrétion d'IL-1β lors de la stimulation du LPS, suggérant son implication dans la régulation de l'inflammation par la glycolyse. L'inversion partielle des effets anti-inflammatoires de l'inactivation d'ALDOA avec un supplément de pyruvate a indiqué un rôle limité de la LDHA dans les réponses inflammatoires.
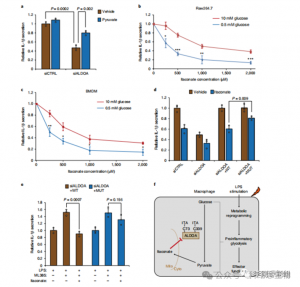
Figure 5 : L'action anti-inflammatoire de l'itaconate est médiée par son inhibition de l'ALDOA, entraînant une perturbation de la glycolyse
En résumé, cet article a exploité efficacement les technologies de profilage de la cystéine basées sur la S-glycosylation et les méthodologies ABPP pour construire un réseau d'interactions entre l'itaconate et les protéines apparentées. Cela démontre de manière convaincante que l’itaconate joue le rôle de régulateur métabolique essentiel en modifiant spécifiquement les résidus de cystéine sur les protéines pour contrôler la voie glycolytique. Cette recherche élucide non seulement le mécanisme d'action de l'itaconate en tant que nouveau régulateur métabolique, mais fournit également des preuves solides de la manière dont les petits métabolites interagissent avec les protéines pour moduler les voies métaboliques principales.
En plus de l'ABPP, d'autres méthodes pour étudier les interactions entre les métabolites de petites molécules et les protéines comprennent, sans s'y limiter :
1. Enrichissement par affinité (pull-down)techniques, où le composé natif est converti en une sonde biotinylée qui incube avec des lysats cellulaires, suivi d'un enrichissement médié par la streptavidine et de l'isolement de cibles protéiques qui se lient à la sonde de biotine.
2.Spectrométrie de masse à protéolyse limitée (LiP-MS)est une technologie de découverte de cibles basée sur l'affinité protéique. Lorsque des ligands spécifiques, tels que des médicaments ou de petites molécules, se lient à des protéines particulières, ils induisent des changements de conformation ou des obstacles stériques conduisant à des sites de clivage différentiels par rapport à la protéine non liée. En détectant ces différences à l'aide de la spectrométrie de masse, cette méthode peut identifier les interactions médicament-protéine au sein des cellules et déterminer les cibles moléculaires du médicament.
3.Test de déplacement thermique cellulaire (CETSA)a été initialement développée pour faciliter la recherche sur les cibles de médicaments anticancéreux et constitue l’une des premières méthodes sans étiquette largement utilisées pour étudier l’engagement des cibles de médicaments dans des cellules intactes. CETSA repose principalement sur le principe selon lequel, en se liant à une protéine cible, un composé augmente sa stabilité thermique. Après avoir incubé les échantillons avec le composé et les contrôles correspondants à différents gradients de température, les protéines liées au ligand restent repliées et relativement stables après chauffage, tandis que les protéines non liées se déplient et précipitent en raison de la dénaturation. L'analyse ultérieure de la thermostabilité des protéines solubles par des approches basées sur l'immunotransfert ou la spectrométrie de masse, basées sur leurs courbes de fusion, confirme l'interaction entre le composé et les protéines intracellulaires.
4. Chromatographie d'affinitéconsiste à conjuguer le métabolite cible à une matrice en phase solide pour capturer les complexes protéiques qui interagissent avec lui. Les protéines capturées sont ensuite identifiées à l'aide de techniques telles que la spectrométrie de masse.
5.Résonance Plasmon de Surface (SPR)est utilisé pour la mesure en temps réel et sans étiquette des paramètres cinétiques associés aux interactions entre les petites molécules et les protéines.
6. Cristallographie des protéinesélucide les structures tridimensionnelles des protéines complexées avec des ligands à petites molécules, fournissant un aperçu intuitif des sites de liaison et des mécanismes d'action. En résolvant ces structures, les chercheurs peuvent visualiser directement comment les petites molécules interagissent avec leurs cibles protéiques.

