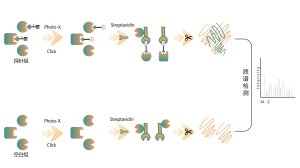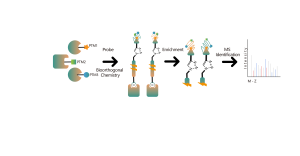Produits
Profilage chimioprotéomique des cibles protéiques pour les médicaments non covalents à petites molécules
Caractéristiques techniques de la plateforme
Les médicaments à petites molécules jouent un rôle important dans le domaine de la R&D pharmaceutique. Les médicaments actuellement approuvés par la FDA ciblent un total de 812 protéines humaines distinctes. Parmi les médicaments dirigés contre les cibles mentionnées ci-dessus, 84 % sont des médicaments à petites molécules. De plus, seules 639 de ces protéines ont été ciblées par des médicaments à petites molécules. L’interaction entre un médicament à petites molécules et une cible protéique comprend des modes non covalents et covalents, le premier étant actuellement dominant.
Les interactions non covalentes, telles que les liaisons hydrogène et l'empilement π-π, peuvent être perturbées en raison de la dénaturation des protéines. Pour relever ce défi, notre plateforme utilise le marquage par photoaffinité, une technique bien établie pour attacher avec précision des « marqueurs chimiques » au site actif d'une protéine. De plus, notre stratégie innovante de réticulation chimique in situ transforme les interactions protéiques non covalentes transitoires en liaisons chimiques covalentes et permanentes. En utilisant une sonde chimique fonctionnalisée avec des fragments de photoaffinité et de bioorthogonaux, la plate-forme chimioprotéomique de ChomiX a démontré son efficacité pour détecter avec succès des cibles protéiques dans les lysats cellulaires, les tissus et les cellules vivantes. Le spectre des médicaments bioactifs à petites molécules appliqués dans la plateforme englobe une variété de composés, notamment des métabolites endogènes, des produits naturels et des molécules synthétiques non covalentes.

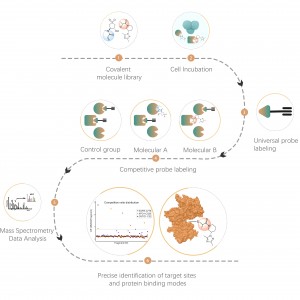
Flux de travail

La plateforme suit un flux de travail structuré, commençant par le marquage de cellules vivantes à l'aide d'une sonde de photoaffinité dérivée de molécules non covalentes. Les étapes suivantes comprennent l’extraction de protéomes marqués, la ligature bioorthogonale, l’enrichissement à base de streptavidine, la digestion par protéase, le marquage isotopique et enfin la détection par spectrométrie de masse.
Étude de cas
Objectif du projet
Le composé A a montré une bonne activité anti-prolifération dans le test de viabilité cellulaire. La plateforme chimioprotéomique a été utilisée pour caractériser les cibles protéiques.
Méthode expérimentale
La sonde chimique de photoaffinité, la sonde A, a été conçue et synthétisée sur la base des données SAR du composé A. La sonde A a également montré une activité anti-prolifération similaire dans la lignée cellulaire tumorale. Des expériences basées sur gel et MS ont été réalisées. Les données MS ont été analysées pour élucider le MOA.
Visualisation des données

Les résultats de fluorescence sur gel ont montré que la sonde A pouvait marquer efficacement les protéines et que le signal de marquage pouvait être significativement concurrencé par le composé A. Collectivement, ces données ont indiqué que la sonde A pouvait être utilisée comme outil de sonde chimique pour la découverte ultérieure de cibles puisque il pourrait lier les mêmes protéines que le composé A.



Le tracé du volcan a montré que 114 protéines (surbrillance rouge) étaient enrichies de manière significative par la sonde A dans le groupe sonde A vs DMSO (direct), et 38 protéines (surbrillance rouge) étaient en compétition par le composé A de manière significative dans la sonde A vs (A + sonde A). ) Groupe (Concours). Les diagrammes de Venn ont montré que 32 protéines superposées pourraient être des cibles potentielles de liaison au composé A avec un niveau de confiance élevé.(n = 3, rapport ≥2,valeur p ≤ 0,05)