Utilisation de la protéomique chimique pour identifier la cible fonctionnelle SLC25A20 du mébutate d'ingénol pour la kératose actinique
Cette étude utilise la protéomique chimique pour dévoiler une nouvelle cible du butylate de méthyle de macromorol (Ing-Meb), un médicament utilisé dans le traitement de la kératose solaire. L’équipe de recherche a initialement conçu et synthétisé une sonde de photoaffinité Ing-Meb nommée Ing-Dayne, qui forme des liaisons covalentes avec des protéines cibles lors de l’exposition à la lumière UV, facilitant ainsi l’identification de cibles fonctionnelles potentielles. Grâce à une validation ultérieure, les auteurs ont identifié SLC25A20 comme une cible essentielle d'Ing-Meb. SLC25A20 est une translocase carnitine-acylcarnitine liée à la membrane mitochondriale impliquée dans le métabolisme des acides gras. Notamment, l'action inhibitrice d'Ing-Meb sur la fonction SLC25A20 conduit à une accumulation accrue d'acylcarnitines à longue chaîne, ce qui confirme qu'Ing-Meb produit ses effets thérapeutiques en modulant la voie d'oxydation des acides gras. En outre, l'étude se penche sur l'importance des modifications structurelles dans les recherches sur les produits naturels. En synthétisant la sonde de photoaffinité Ing-Dayne par modification structurelle d'Ing-Meb, les chercheurs ont réussi à découvrir une nouvelle cible distincte de la compréhension conventionnelle. Cela améliore non seulement la compréhension d'Ing-Meb et de son mode d'action, mais souligne également le rôle central de la modification structurelle dans la recherche en protéomique chimique pour démêler les complexités des produits naturels. De telles connaissances propulsent davantage l’innovation pharmaceutique, englobant l’optimisation de l’efficacité des médicaments existants, le développement de nouvelles thérapies ciblant des entités spécifiques et l’élucidation des mécanismes des effets secondaires des médicaments.
Itinéraire de recherche
Processus expérimental
1. La conception de la sonde synthétique de photoaffinité Ing-Dayne dévoile le mécanisme sous-jacent à la liaison du médicament contre la kératose actinique Ing-Meb à sa protéine cible.
Dans cette étude, la sonde d'affinité Ing Ing-Dayne, dérivée du médicament thérapeutique Ing-Meb contre la kératose actinique, a été utilisée (voir Figure 1). Grâce à la co-culture de cette molécule sonde avec des cellules spécifiques et à l'irradiation ultérieure par la lumière UV, la double structure d'acridine à l'intérieur de la sonde a formé des liaisons covalentes stables avec des protéines intracellulaires. Lors de la lyse cellulaire, une réaction chimique Click a facilité la fixation du groupe rapporteur azide-tétraméthylrhodamine à la protéine cible (comme illustré sur la figure 2). Une analyse SDS-PAGE ultérieure (représentée sur la figure 3) a révélé qu'Ing-Meb présentait un effet de liaison compétitif significatif sur la sonde, alors qu'Ingenol, possédant une structure similaire, ne démontrait pas d'inhibition compétitive.
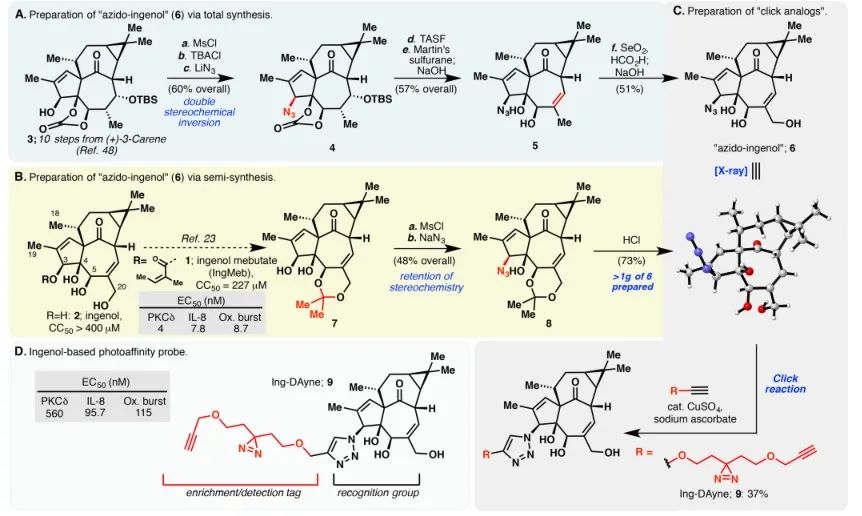
Figure 1 : Illustre les deux voies de synthèse utilisées pour la synthèse d’Ing-Dayne.
2. La nouvelle sonde 11b a identifié 44 protéines cibles du BBR liées à l'inflammation dans les cellules THP-1 et a révélé EIF2AK2, eEF1A1, PRDX3 et VPS4B comme cibles directes ayant des interactions spécifiques avec le BBR.
Les auteurs, grâce à une série d'expériences, ont utilisé avec succès la nouvelle sonde 11b pour marquer et purifier les protéines cibles potentielles dans les cellules THP-1. Suite à cela, ils ont utilisé l'analyse LC-MS/MS pour identifier 44 protéines associées à l'inflammation dans la plage de poids moléculaire de 20 à 80 kDa, parmi lesquelles six jouent potentiellement un rôle critique dans les actions anti-inflammatoires du BBR. Au cours d'enquêtes plus approfondies, EIF2AK2, eEF1A1, PRDX3 et VPS4B ont été confirmés comme cibles directes du BBR, présentant des effets d'inhibition compétitifs sous des concentrations élevées de traitement par BBR. Cette découverte a révélé l’existence probable d’interactions spécifiques entre ces protéines et le BBR, élucidant ainsi de nouvelles informations sur leur engagement avec le médicament au cours de ses processus anti-inflammatoires.
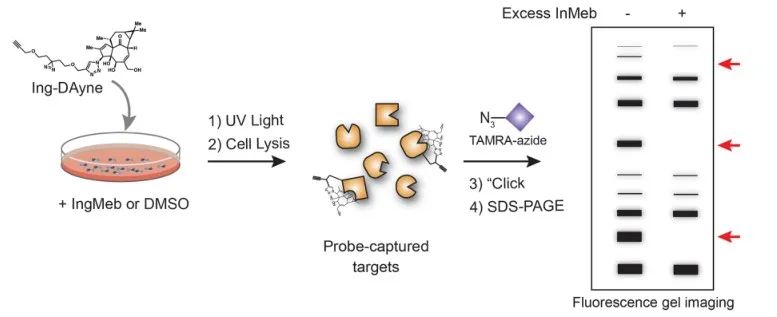
Figure 2 : Processus de validation sur gel de la cible Ing-Dayne.
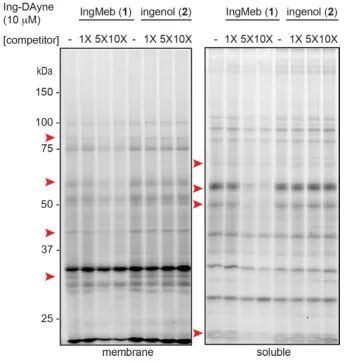
Figure 3 : Inhibition compétitive d’Ing-Meb et d’ingénol sur la molécule sonde Ing-Dayne.
3. Le dépistage SILAC, combiné à la validation par Western blot, a identifié SLC25A20 comme cible principale du médicament de classe Ingenol, Ing-Meb.
Les auteurs ont initialement examiné 28 protéines cibles potentielles à l’aide de la technologie SILAC (Stable Isotope Labeling by Amino Acids in Cell Culture) (Figure 4). Par la suite, grâce à d’autres expériences de criblage et de validation par Western blot (Figure 5), les chercheurs ont observé qu’Ing-Meb présentait l’effet inhibiteur le plus puissant sur SLC25A20 parmi ces cibles candidates, ce qui suggère fortement que SLC25A20 est l’une des principales cibles fonctionnelles d’Ing-Meb.
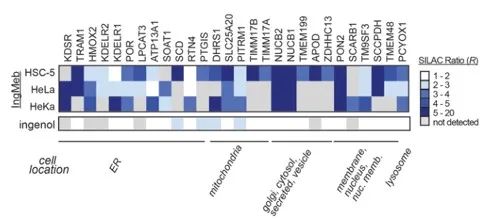
Figure 4 : Les 28 cibles potentielles obtenues par le dépistage initial.
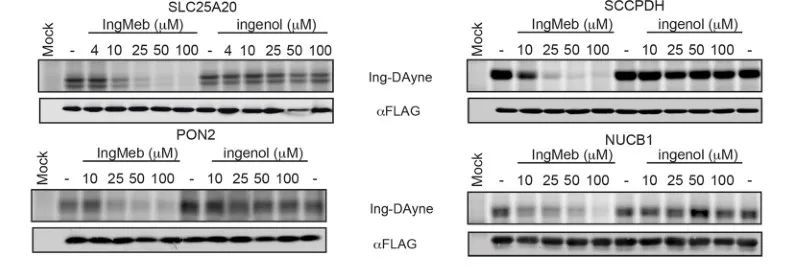
Figure 5 : Expériences de Western blot de quatre protéines cibles potentielles.
4. Ing-Meb régule la voie d'oxydation des acides gras en inhibant SLC25A20, une protéine de la membrane mitochondriale également connue sous le nom d'alcalipoyltransférase botulique, révélant ainsi sa cible en tant que médicament contre la kératose actinique.
Les auteurs ont étudié la SLC25A20, également connue sous le nom de lipoyltransférase alcaline botulique ou CACT, une protéine membranaire intégrale multimodale localisée dans la membrane mitochondriale. Sa fonction principale implique le transport des acylcarnitines à longue chaîne dans les mitochondries, facilitant leur échange avec la carnitine libre. Ces acylcarnitines transportées sont ensuite converties en acylCoA gras par la carnitine palmitoyltransférase-2 (CPT-2), servant ainsi de précurseurs à la β-oxydation des acides gras. Les résultats expérimentaux ont révélé une augmentation significative de la teneur en acylcarnitine à longue chaîne cellulaire avec des concentrations croissantes du médicament contre la kératose actinique Ing-Meb (représenté sur la figure 6). Cette observation soutient fortement l'effet inhibiteur d'Ing-Meb sur SLC25A20, confirmant ainsi SLC25A20 comme l'une des principales cibles médiatrices de l'action d'Ing-Meb.
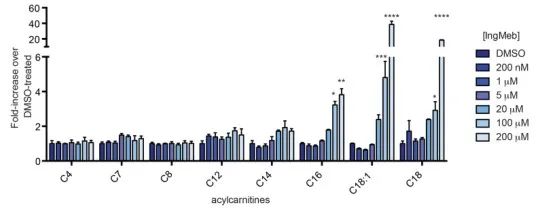
Figure 6 : Effet d’Ing-Meb sur les acylcarnitines à longue chaîne
5. Validation indirecte de l'effet cytotoxique d'Ing-Meb via l'expression de SLC25A20 : révélant sa fonction cible dans la régulation de l'activité des médicaments.
Les enquêteurs ont cherché à lier directement l'inhibition de SLC25A20 dans les cellules HeLa aux effets cytotoxiques potentiels d'Ing-Meb. Les résultats ont indiqué que même si la surexpression de SLC25A20 ne modifiait pas la moitié de la concentration inhibitrice d'Ing-Meb dans ces cellules, il est à noter qu'une expression accrue de SLC25A20 atténuait de manière significative l'impact d'Ing-Meb sur l'accumulation d'acylcarnitine à longue chaîne (représenté dans la figure 7). . Ce résultat confirme encore l'hypothèse selon laquelle SLC25A20 sert de cible fonctionnelle essentielle pour l'activité médicamenteuse d'Ing-Meb.
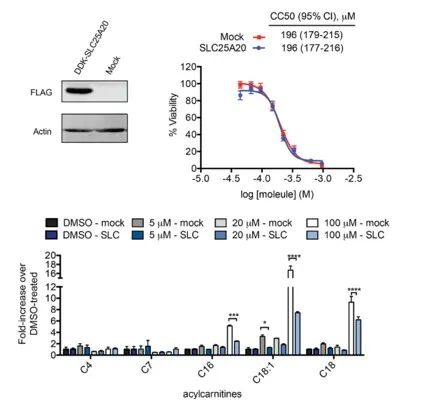
Figure 7 : Effet de l'expression ou non de SLC25A20 sur CC50 et acylcarnitine.
Cette étude révèle non seulement les nouvelles cibles d'Ing-Meb, mais fournit également une nouvelle base théorique et une nouvelle orientation stratégique pour la découverte ciblée de produits naturels structurellement complexes. Référence:
Référence:https://doi.org/10.1021/acscentsci.7b00420.

