[Percée à score élevé] Faire progresser la régulation anti-inflammatoire du SLC15A4 avec le nouvel inhibiteur AJ 2-30 : une approche protéomique chimique (IF 14.8)
Cet article utilise la protéomique chimique pour concevoir et cribler une gamme de nouveaux inhibiteurs ciblant SLC15A4, une protéine transmembranaire inflammatoire cruciale hautement exprimée dans les cellules présentatrices d'antigènes. Le ciblage initial des inhibiteurs potentiels a utilisé la stratégie de bibliothèque de sondes de fragments entièrement fonctionnalisés (FFF), identifiant FFF-21 comme un puissant inhibiteur de la production d'IFN-α parmi de nombreuses sondes. L'optimisation structurelle ultérieure a conduit au développement du composé AJ 2-30, qui a non seulement démontré une inhibition exceptionnelle, mais a également confirmé SLC15A4 comme sa principale modification post-photoréticulation cible. Des investigations plus approfondies ont révélé que l'AJ 2-30 exerçait de puissants effets anti-inflammatoires en réduisant la stabilité du SLC15A4, en induisant sa dégradation via la voie lysosomale et en inhibant efficacement l'activation du TLR 7-9 et du NOD. Cette étude permet non seulement de mettre au point des inhibiteurs de SLC15A4 dotés d’une activité anti-inflammatoire significative, mais ouvre également la voie au développement de nouveaux médicaments anti-inflammatoires.

Itinéraire de recherche
Processus expérimental
1. Stratégie de bibliothèque de sondes de fragments entièrement fonctionnalisés (FFF) pour rechercher les inhibiteurs de SLC15A4.
Les auteurs ont commencé leur étude en criblant les inhibiteurs de SLC15A4 à l’aide d’une bibliothèque de sondes de fragments entièrement fonctionnalisés (FFF). Ce FFF comprend deux composants : un groupe de reconnaissance moléculaire contenant des fragments de comprimés conçus pour cibler SLC15A4, et un autre groupe enrichi photo-réticulé comprenant des groupes doubles acrimidine et alcyne pour visualiser SLC15A4. En utilisant un flux de travail de protéomique chimique, les auteurs ont confirmé la liaison de cette bibliothèque de sondes FFF à SLC15A4 dans les cellules et ont évalué si la sonde FFF pouvait atténuer les niveaux d'IFN-α dans les cellules stimulées par TLR 9. Les résultats ont démontré que parmi toutes les sondes FFF se liant à SLC15A4, FFF-21 présentait la capacité la plus élevée à inhiber les niveaux d'IFN-α, tandis que son analogue sans marquage, FFF-21c, présentait également des effets inhibiteurs similaires.
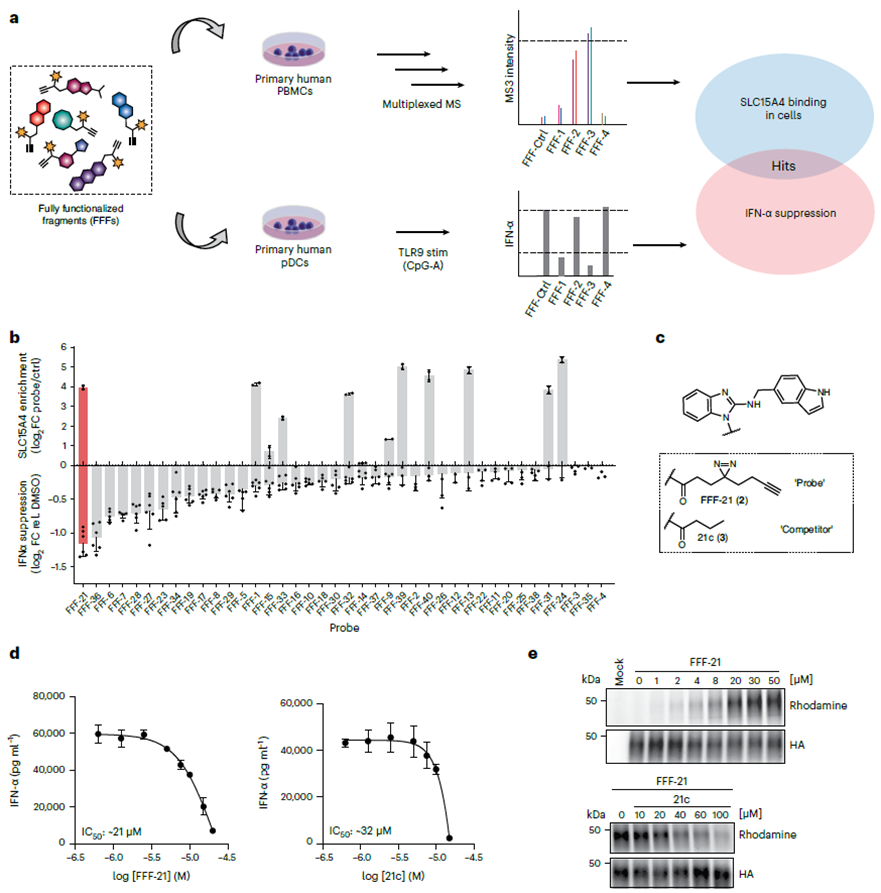
2. Modification de photoréticulation des inhibiteurs de SLC15A4.
Suite à la sélection initiale du composé FFF-21c, les auteurs ont procédé à l’optimisation de sa structure. Grâce à la synthèse de plusieurs analogues du FFF-21c, ils ont identifié l'AJ 2-30 comme l'inhibiteur le plus puissant. En employant des techniques de photoréticulation, ils ont confirmé son interaction avec la cible. Par la suite, en utilisant à la fois la méthode de marquage direct et la méthode de compétition indirecte de l’ABPP, ainsi que l’analyse du déplacement thermique cellulaire (CETSA), les auteurs ont définitivement établi SLC15A4 comme cible principale de l’AJ 2-30.
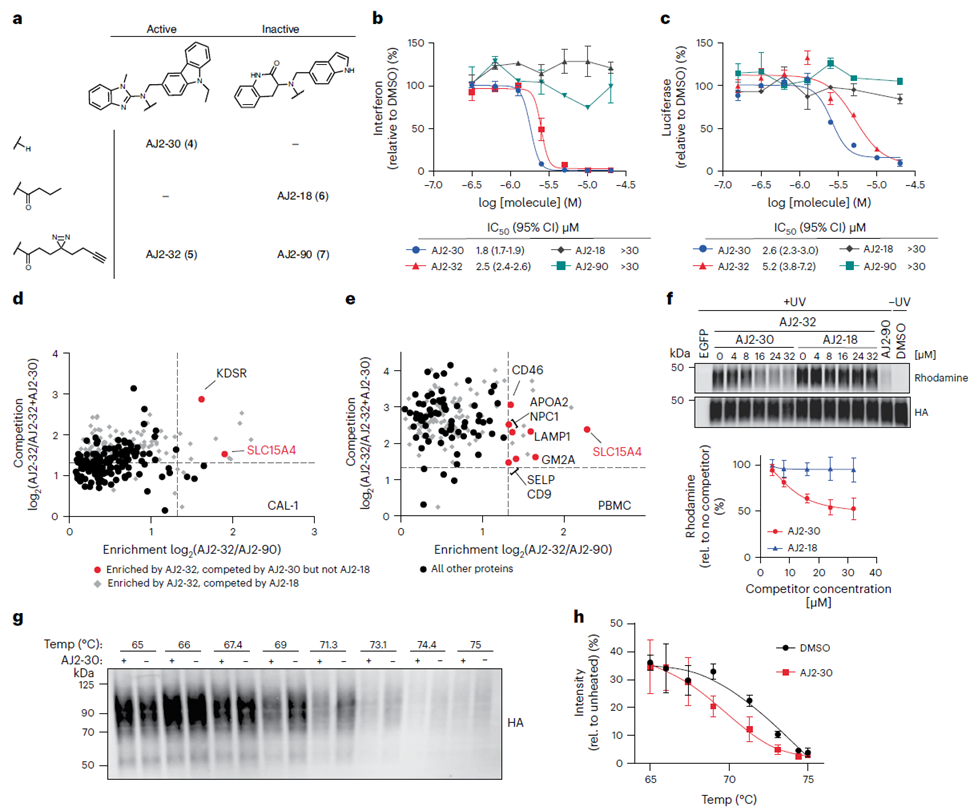
3. Le mécanisme anti-inflammatoire révèle que l'AJ 2-30 perturbe la stabilité du SLC15A4.
Après confirmation de la liaison de l'AJ 2-30 au SLC15A4 et de son effet inhibiteur, les auteurs ont mené une série d'expériences biochimiques pour élucider le mécanisme anti-inflammatoire de l'AJ 2-30. Les résultats ont révélé que l'AJ 2-30 induit une dégradation de SLC15A4 médiée par les lysosomes en déstabilisant la protéine, inhibant ainsi l'activation du TLR 7-9 et du NOD dans les cellules immunitaires d'une manière dépendante de SLC15A4. Cela souligne le potentiel de l’AJ 2-30 dans le traitement des maladies inflammatoires et auto-immunes.
En résumé, cette étude utilise habilement des techniques de protéomique chimique pour identifier l'AJ 2-30, un puissant inhibiteur de SLC15A4 doté d'une activité anti-inflammatoire remarquable. Ce composé démontre une efficacité significative dans des modèles animaux en ciblant spécifiquement la stabilité de SLC15A4 et son rôle dans la présentation des antigènes et les voies de signalisation inflammatoires. Cette avancée cruciale améliore non seulement notre compréhension des cibles thérapeutiques anti-inflammatoires, mais établit également une base solide pour le développement futur de nouveaux agents thérapeutiques pour une variété de maladies inflammatoires et auto-immunes. Grâce à des recherches plus poussées et à une validation clinique, ces nouveaux inhibiteurs du SLC15A4 sont sur le point d'offrir des options de traitement plus précises et plus efficaces à une multitude de patients, ayant ainsi un impact profond sur la santé mondiale.

