Contexte technique
La technologie chimique protéomique apparaît comme un phare du changement, éloignant la découverte de médicaments des protéines purifiées vers le domaine des cellules vivantes.
La technologie chimique protéomique constitue une solide plateforme de découverte de médicaments, caractérisée par l’étude des interactions petites molécules-protéines au sein des cellules vivantes. L'une de nos plateformes de découverte de médicaments covalents est conçue pour découvrir des liants covalents qui engagent des cibles protéiques via des réactions covalentes avec le groupe thiol des résidus cystéine. Contrairement aux stratégies traditionnelles de criblage à cible unique, la plateforme de protéomique chimique permet une analyse quantitative des interactions entre les fragments électrophiles et presque toutes les protéines des cellules vivantes avec la résolution des résidus d'acides aminés. Il couvre plus de 10 000 protéines et~ 40 000 sites de cystéine (sites potentiels de liaison aux médicaments) provenant de plusieurs lignées cellulaires de mammifères.

Flux de travail
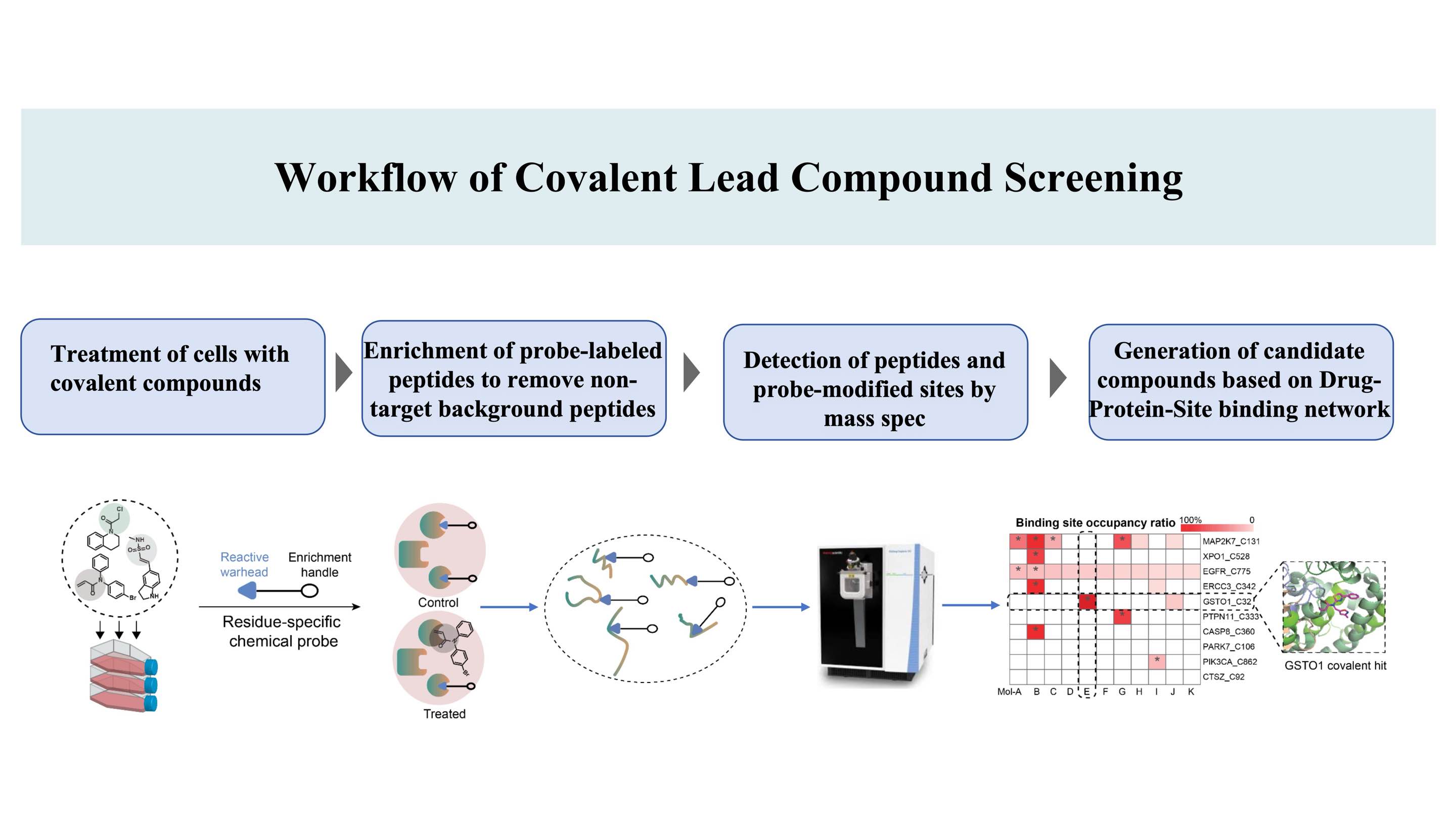
Le workflow de découverte de composés covalents ciblant les sites de liaison*sur les protéines, basé sur le brevet DIA-ABPP (Data-Independent Acquisition-Activity-Based Protein Profiling) (Un site de liaison covalent est un acide aminé qui peut être marqué par des sondes chimiques, permettant ainsi la ligandabilité)
Avantages techniques
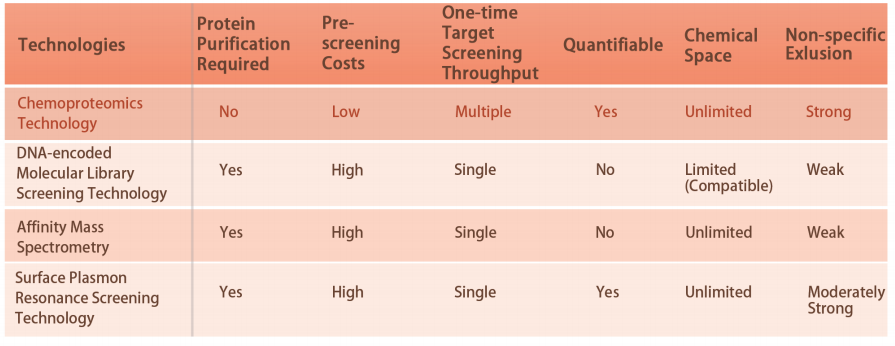
Caractéristique 1
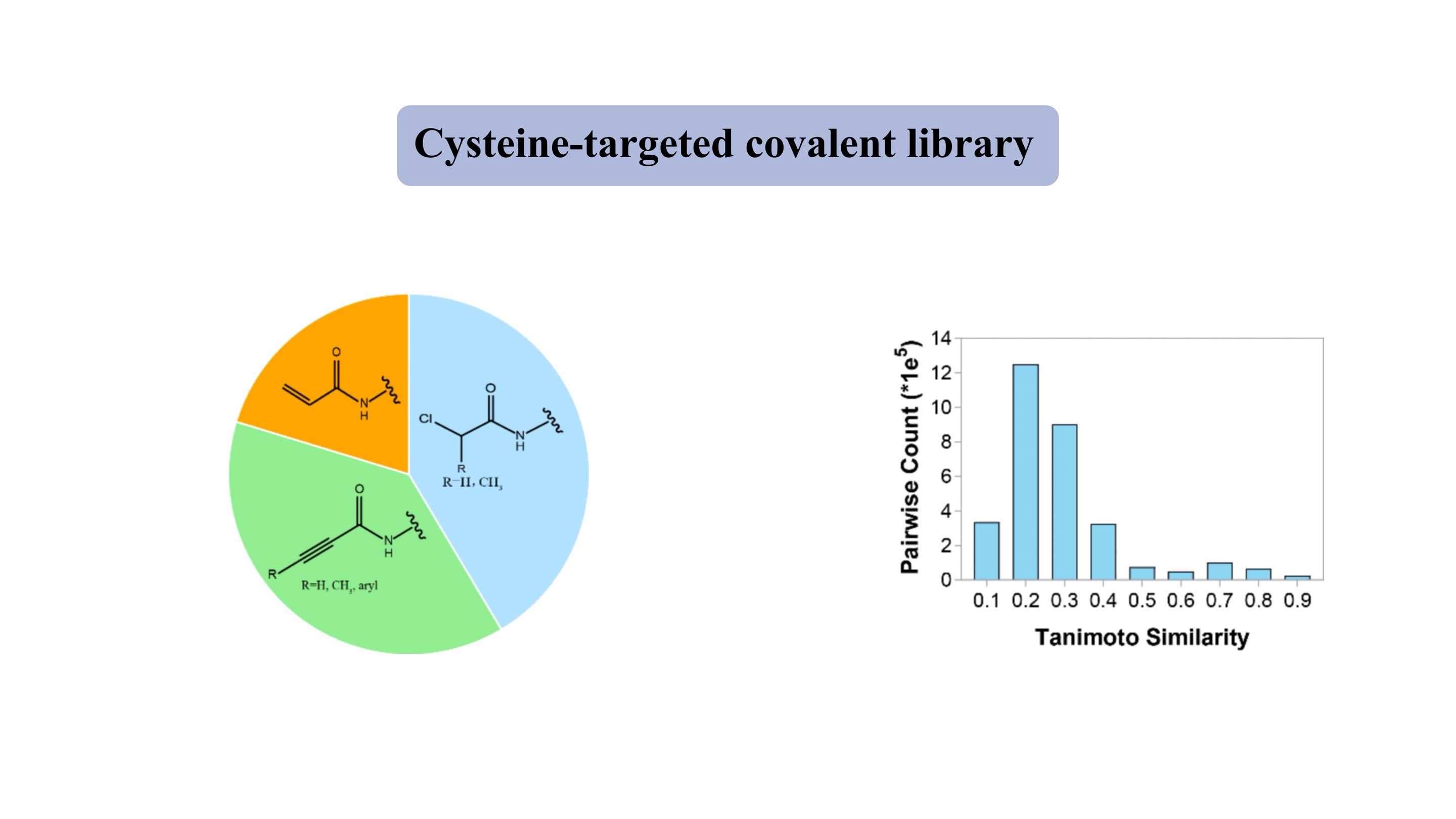
Bibliothèque covalente ciblée sur la cystéine
La bibliothèque covalente ciblée sur la cystéine contient des « ogives » électrophiles douces représentatives, telles que les acrylamides et les chloroacétamides. La bibliothèque « de type médicamenteux » contient environ 3 000 composés, dont plus de 80 % présentent un poids moléculaire de 300 à 500 Da. Pour la plupart des composés, l'indice de similarité de Tanimoto est d'environ 0,3 pour deux membres, ce qui indique un degré élevé de diversité.
Caractéristique 2
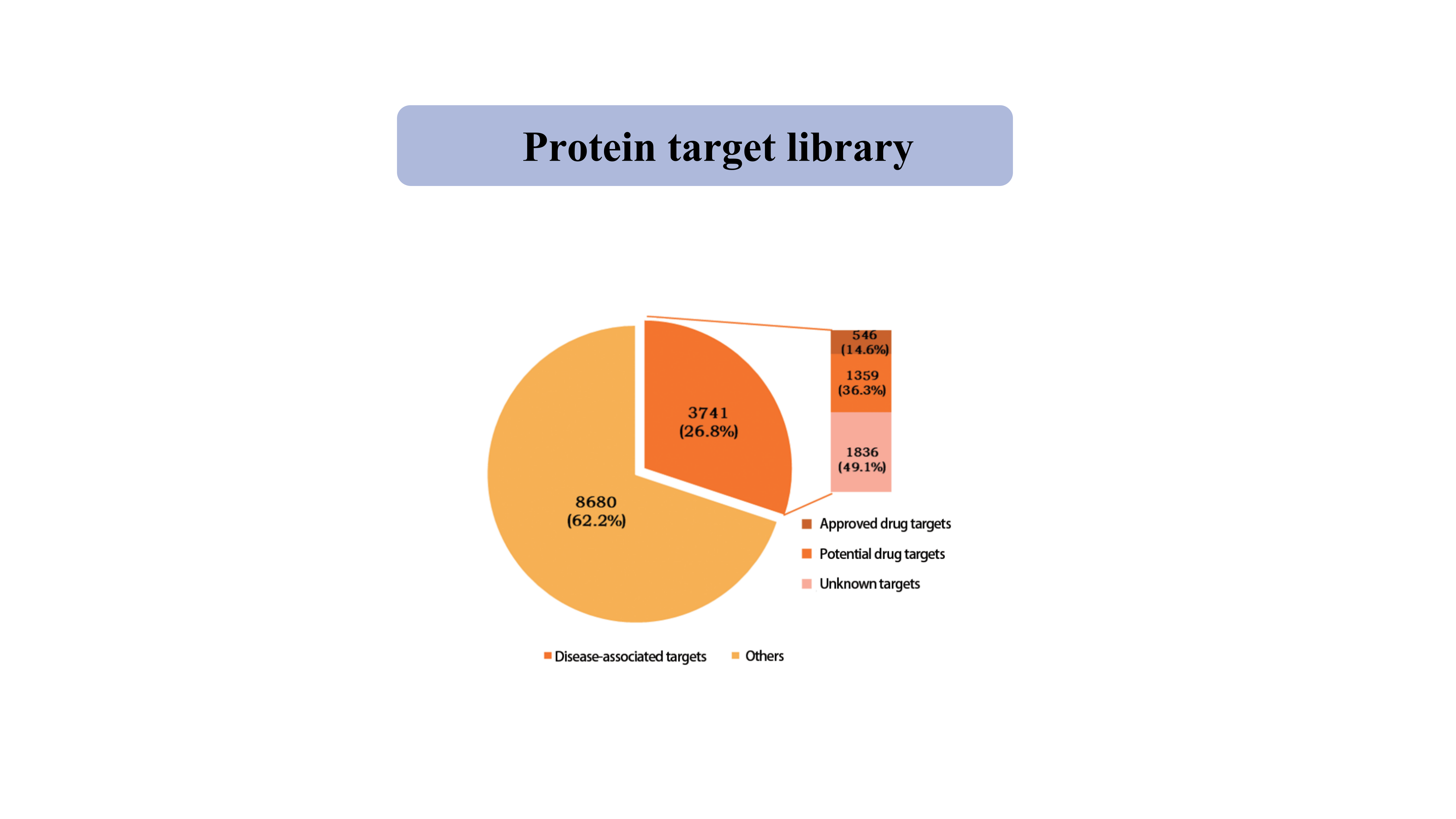
Cible protéiquebibliothèque
Actuellement, la bibliothèque de cibles protéiques capturées par la sonde chimique spécifique du thiol couvre 39 962 sites de cystéine provenant de 12 421 protéines, notamment des kinases, des phosphatase, des ligases et des facteurs de transcription.
Étude de cas
DCAF1 sert de récepteur substrat pour deux ligases E3 distinctes (CRL4DCAF1 et EDVP), jouant un rôle physiologique essentiel dans la dégradation des protéines. Plusieurs liants covalents et non covalents ciblant le domaine WDR de DCAF1 ont été développés pour prendre en charge des applications de dégradation ciblées (Targeted Protein Degradation by Electrophil PROTACs that Stereoselectively and Site-Specifically Engage DCAF1. J. Am. Chem. Soc. 2022, 144, 40, 18688 –18699. PROTAC basés sur DCAF1 avec une activité contre des cibles cliniquement validées. surmonter la résistance intrinsèque et acquise des dégradateurs. Nat Commun. 2024, 15, 275).
Nous avons découvert pour la première fois que Mol-380 interagit de manière covalente avec DCAF1_C69, le soulignant comme un site potentiellement médicamenteux pour les applications TPD, distinct du domaine WDR. Nos résultats mettent en évidence la valeur significative de la plateforme protéomique chimique automatisée ChomiX dans la découverte de nouveaux ligands pour des cibles non médicamentables dans les cellules vivantes, notamment les facteurs transcriptionnels et les protéines membranaires, soulignant ainsi son impact potentiel dans le développement de médicaments et l'exploration fonctionnelle.
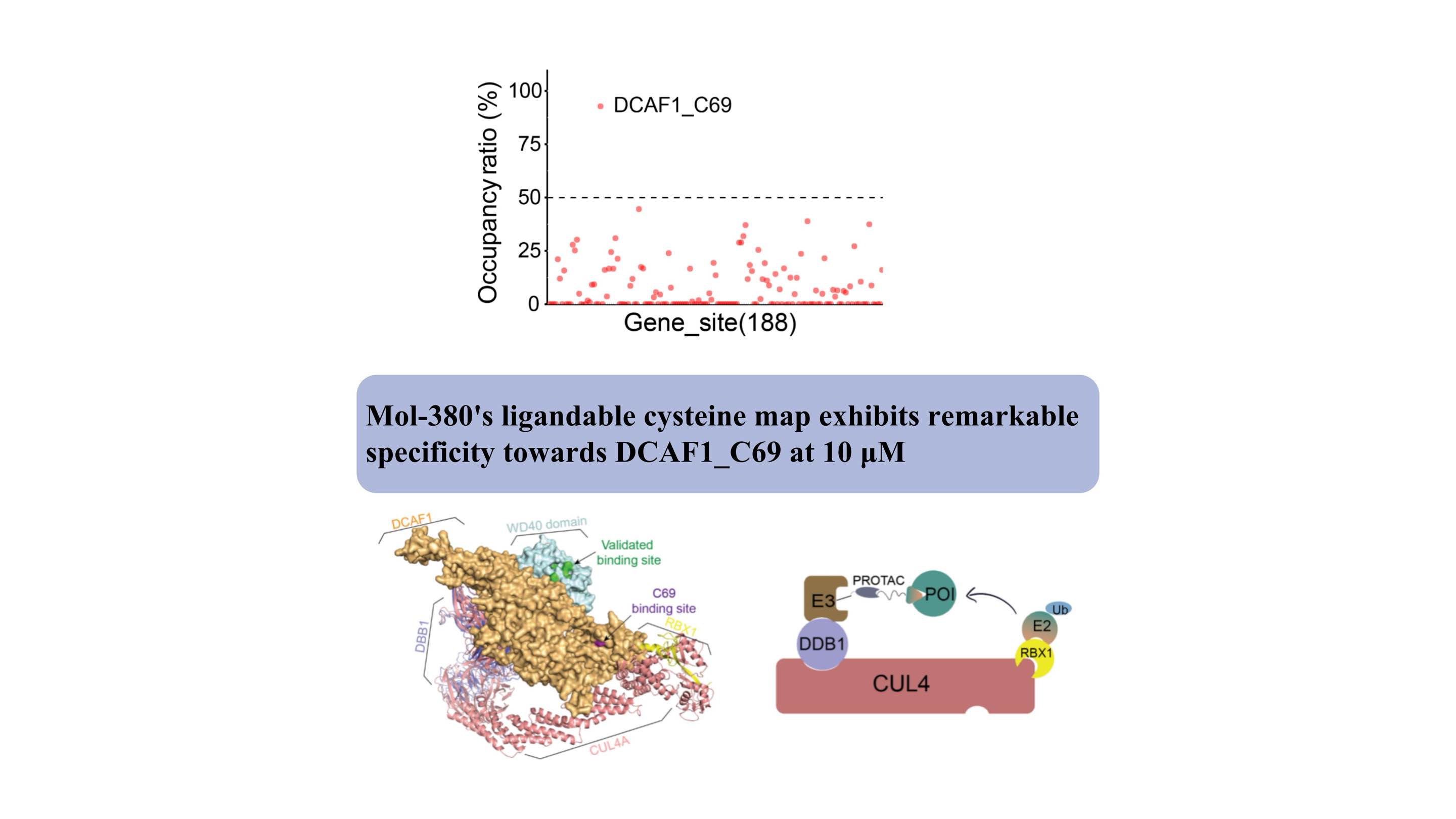
Structurellement, le site de liaison de C69 est adjacent à la poche validée sur le domaine WD40, comme l'indique le modèle complexe, offrant un nouveau site pour le développement de PROTAC.

