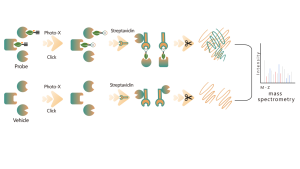Produits
Analyse omique des modifications post-traductionnelles de la cystéine
La cystéine, avec sa réactivité remarquable, joue un rôle central dans la structure et la fonction des protéines. Servant de réactif nucléophile, de centre catalytique redox, de ligand d’ions métalliques et de site clé pour les changements conformationnels, il participe largement et influence profondément l’activité des protéines et les mécanismes de régulation. Il convient de noter que les résidus de cystéine sont susceptibles de subir divers types de modifications post-traductionnelles (PTM), qui non seulement ajustent finement les propriétés fonctionnelles des protéines, mais peuvent également conduire à des déficiences fonctionnelles. Compte tenu de l’association étroite de ces modifications avec de nombreuses maladies humaines majeures, l’analyse qualitative et quantitative des PTM de la cystéine dans les protéines est d’une importance capitale. Cela revêt une valeur indispensable pour une compréhension approfondie des fonctions biologiques des protéines concernées et de leurs mécanismes d’action dans les états de santé et de maladie.
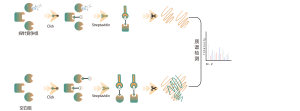
Chomix possède une riche expérience dans l'identification des modifications de la cystéine, telles que la persulfuration de la cystéine. En utilisant de manière innovante des sondes de cystéine universelles basées sur la différence de pKa entre -SH et -SSH, nous ajustons le pH pour réduire les interférences de fond provenant de -SH, permettant ainsi aux sondes de marquer principalement -SSH et d'identifier ainsi efficacement les sites de sulfénylation.
Chomix possède une technologie avancée de spectrométrie de masse capable de résoudre directement et avec précision divers types de modifications post-traductionnelles des protéines et leurs sites spécifiques. Grâce à une intégration intelligente de techniques de séparation et d'enrichissement avec le marquage isotopique et d'autres méthodes avancées, nous permettons une analyse qualitative et quantitative à grande échelle et à haut débit de diverses modifications, fournissant ainsi un support technique solide pour une recherche approfondie sur les modifications post-traductionnelles des protéines.

Nos avantages
1. Expertise professionnelle : Forts d’une vaste expérience et de publications dans des revues de premier plan, nous proposons des services sur mesure pour des résultats optimaux.
2. Gestion rigoureuse de la qualité : nos systèmes de qualité matures adhèrent aux normes ISO9001, garantissant des rapports fiables.
3. Service complet : De la conception de la sonde à l'analyse bioinformatique, nous fournissons une consultation tout-en-un jusqu'à la livraison, avec des mises à jour ponctuelles des progrès.
4. Équipement avancé : Équipés de spectromètres de masse de pointe comme le Thermo Fisher Orbitrap Exploris 480 et le Bruker timsTOF, nous soutenons la recherche révolutionnaire.
Notre service
| Projet | Analyse omique des modifications post-traductionnelles de la cystéine |
| Échantillon | Protéine pure, lysat cellulaire, cellules vivantes, tissus malades, sang, bactéries, tissus végétaux |
| Plateforme matérielle | Pulvérisateur de cellules ultrasoniques sans contact, système d'imagerie ChemiDoc MP, spectromètre de masse Orbitrap Fusion Lumos Tribrid/Orbitrap Exploris 480/Q Exactive HF-X/timsTOF Pro 2 |
| Durée du projet | 4-8 semaines |
| Livrables | Rapport de projet (y compris les procédures expérimentales, les graphiques d'analyse des données, les résultats de l'analyse bioinformatique) |
| Prix | Cliquez pour consulter |
Étude de cas
La thiolation fait référence au couplage d'un groupe thiol (-SSH) à des résidus cystéine dans les protéines, médié par le sulfure d'hydrogène (H2S). Pour approfondir ce processus, des protéomes entiers peuvent être extraits d’échantillons de cellules ou de tissus et marqués à l’aide d’une méthode de sonde chimique (sonde spécifique à la cystéine). Contrairement à l’interférence thiol, cette méthode permet un marquage efficace des groupes thiol en ajustant précisément le pH. Par la suite, à l’aide de la spectrométrie de masse à haute résolution, les chercheurs peuvent identifier avec précision les sites de thiolation, élucidant ainsi davantage le rôle important de cette modification post-traductionnelle in vivo.
À l’aide de modèles cellulaires HeLa, le protéome entier a d’abord été extrait. Par la suite, la modélisation avec NaHS et l’ajustement du pH ont permis un marquage précis des groupes thiol par une sonde universelle à cystéine. Grâce à une série d'étapes comprenant l'enrichissement, la digestion enzymatique et la détection par spectrométrie de masse, 180 peptides contenant des modifications -SSH ont été identifiés, ainsi que 120 protéines associées, y compris les sites de thiolation signalés GAPDH_C152 et C247.

Voici les spectres MS/MS des peptides avec modifications -SSH :