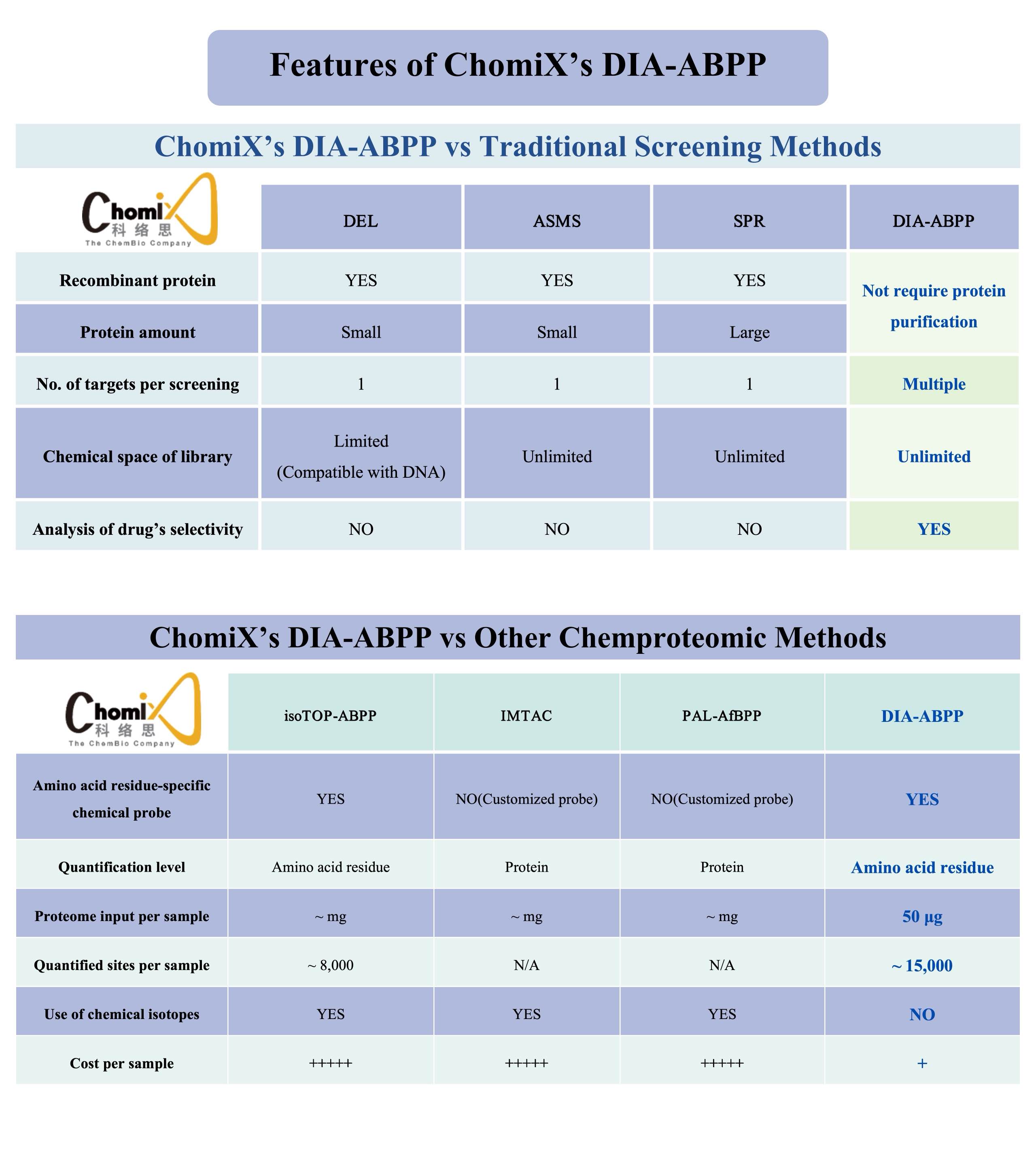
Notre plateforme scientifique,Écran ChomiX, qui est basé sur DIA-ABPP (Data Independent Acquisition-Activity Based Protein Profiling), est une partie importante de notre méthodologie de pointe ABPP. Grâce à notreÉcran ChomiXplateforme technologique, nous pouvons rechercher des composés de plomb covalents à la recherche de cibles non médicamentables. Le processus spécifique comprend le traitement par molécules covalentes de cellules vivantes, la séparation et l'enrichissement de peptides marqués par une sonde chimique, la détection par spectrométrie de masse à haute résolution et la construction d'un réseau de liaison médicament-site cible. Cela nous permet d'évaluer simultanément la capacité de liaison et la sélectivité des médicaments pour des poches spécifiques de résidus d'acides aminés sur plusieurs cibles protéiques, générant ainsi des composés candidats. À l'heure actuelle, nous avons construit une bibliothèque complète de cibles protéiques, y compris la plus grande bibliothèque nationale de composés covalents ciblant la cystéine. , basé sur notre bibliothèque de sondes chimiques et d'autres modules de base caractéristiques.
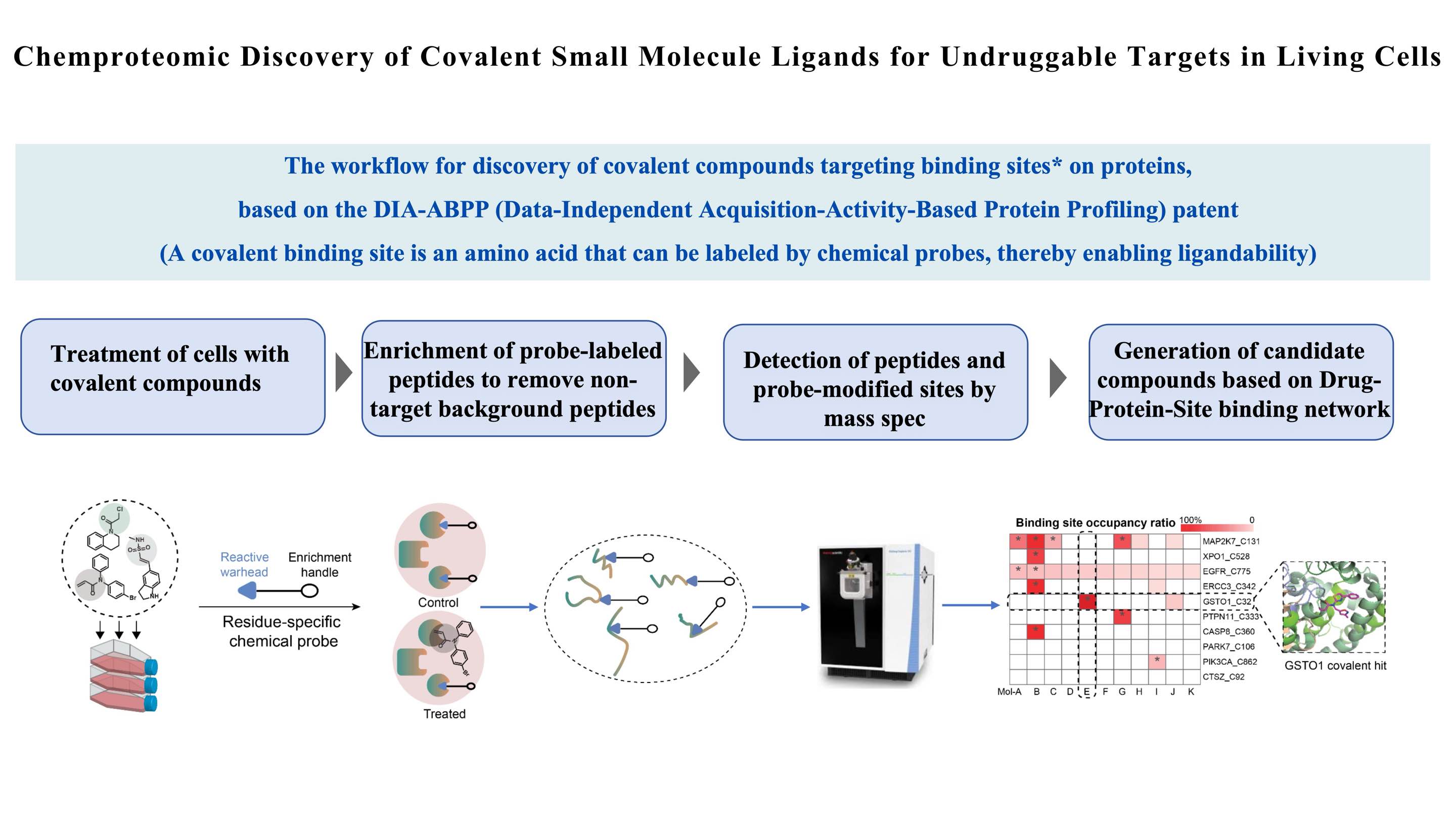
Le taux d'occupation du site de liaison (site Protein_Cys) pour chaque composé est déterminé à l'aide des intensités de spec de masse des peptides quantifiés marqués par une sonde. Essentiellement, la sonde spécifique de la cystéine entre en compétition avec les composés pour se lier à une certaine poche de liaison. Plus le signal du peptide marqué par la sonde est faible, plus la capacité d'occupation du composé est forte. Pour chaque site cystéine de la protéine d'intérêt (POI), la détermination des taux d'engagement cible dépendants de la dose (TE50) est effectuée pour les composés sélectionnés. Les candidats retenus sont ensuite confirmés grâce au classement de leurs valeurs TE50. Plus le TE50 est bas, plus le composé occupe fortement le site cystéine du POI dans les cellules vivantes.