[Financement national d'un projet clé] Démêler les protéines liant les métaux : percées METAL-TPP et innovations en matière de découverte de médicaments
Les protéines liant les métaux sont des composants cruciaux qui forment des complexes stables avec les ions métalliques, remplissant diverses fonctions vitales dans les organismes vivants, notamment la signalisation cellulaire, la catalyse des réactions biochimiques et le maintien de l'homéostasie des ions métalliques. Leur dérégulation est associée à des maladies comme le cancer, les troubles neurologiques et les maladies métaboliques. Comprendre leur rôle dans la pathogenèse de la maladie est essentiel pour le diagnostic et le traitement. De plus, les protéines liant les métaux sont des cibles importantes dans le développement de médicaments, car de nombreux médicaments interagissent avec elles pour exercer des effets thérapeutiques. Dans cette étude, les chercheurs ont présenté METAL-TPP, une méthode de protéomique chimique de pointe. Combinant l'analyse protéomique quantitative de thermostabilité (TPP) avec l'identification des protéines se liant aux métaux, METAL-TPP permet une détection efficace et précise des protéines se liant aux métaux. Il régule notamment la thermostabilité des protéines à l’aide d’une gamme de chélateurs de métaux, facilitant ainsi une identification précise dans les protéines pures et les lysats cellulaires. Cette approche innovante offre de nouvelles connaissances sur la fonction et les mécanismes des protéines de liaison aux métaux, facilitant ainsi la recherche biologique, la compréhension des maladies et le développement de médicaments. Keloxi Biology fournit des ABPP, des TPP et d'autres services techniques avancés en matière de R&D pharmaceutique, aidant les chercheurs à explorer les mécanismes des médicaments et à faire progresser les processus de développement de nouveaux médicaments.

Processus expérimental
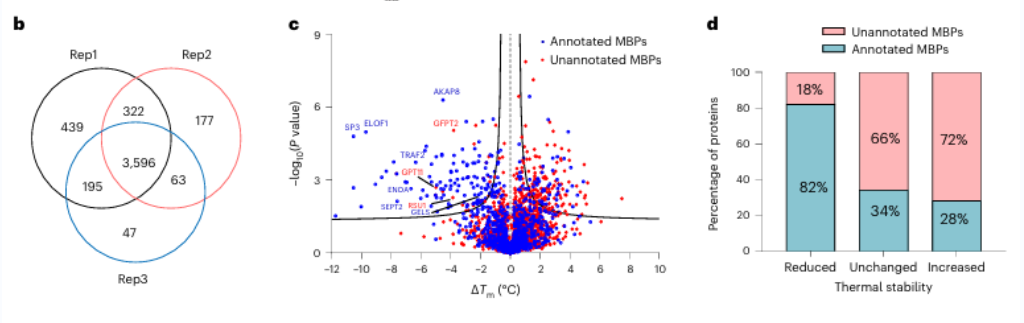
1. Dix-sept protéines potentielles de liaison aux métaux ont été identifiées à l'aide de METAL-TPP.
Initialement, les chercheurs ont évalué l’efficacité de la chélation des métaux à large spectre à l’aide de l’EDTA sur des protéines pures et des lysats cellulaires. Ils ont observé que METAL-TPP détectait efficacement les réductions de la stabilité thermique des protéines liant les métaux. Par la suite, une analyse systématique a été menée sur les protéines d’origine humaine à l’aide de METAL-TPP, identifiant 125 protéines présentant une thermostabilité diminuée. Parmi celles-ci, 102 étaient des protéines de liaison aux métaux déjà connues. De plus, 17 protéines potentielles de liaison aux métaux sans annotation fonctionnelle préalable ont été découvertes, offrant ainsi de nouvelles informations sur le rôle des protéines de liaison aux métaux.
2. L’effet des ions zinc sur la protéine potentielle de liaison aux métaux GFPT2.
Parmi ces 17 protéines potentiellement liant les métaux, les chercheurs ont choisi de procéder à une validation biochimique approfondie sur la protéine GFPT2. GFPT1/2 est la première enzyme limitante dans la voie de biosynthèse de l'hexose, contribuant ainsi à la génération d'une substance appelée UDP-GlcNAc. Les chercheurs ont confirmé au niveau cellulaire que les ions zinc interagissent avec GFPT2, inhibant ainsi son activité. De plus, ils ont observé que la présence d'ions zinc entraîne une réduction significative des niveaux d'UDP-GlcNAc, ce qui indique que les ions zinc régulent la voie de biosynthèse de l'hexose en inhibant l'activité de GFPT2. Il est intéressant de noter que les ions zinc présentent une sélectivité différente pour inhiber les activités de GFPT2 et de GFPT1, suggérant la présence d'un nouveau mécanisme de régulation.
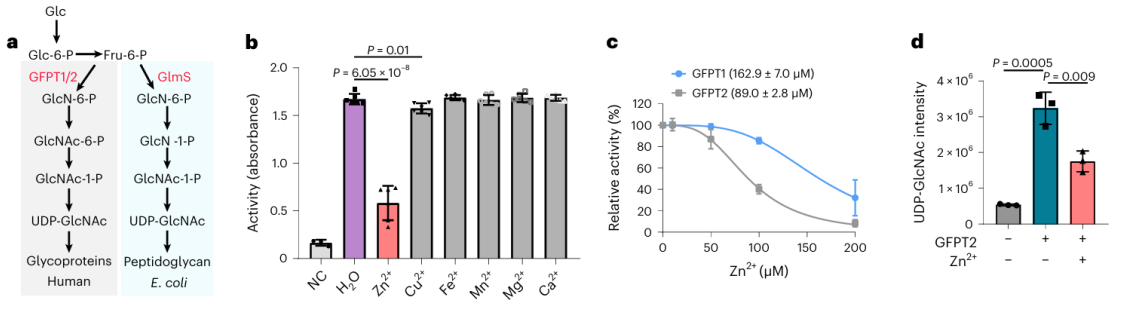
3. Décrypter le mécanisme moléculaire des ions zinc sur l'activité des enzymes GFPT2 et GLMS.
Les chercheurs ont isolé l'homologue de la protéine GFPT2 d'E. coli et ont procédé à une série d'expériences biochimiques et d'analyses de la structure cristalline. Les résultats ont révélé que la protéine GLMS a la capacité de se lier aux ions zinc et que cette liaison a notamment lieu à proximité de la région de liaison au substrat. Cela suggère un scénario potentiel dans lequel les ions zinc pourraient entrer en compétition pour la liaison au site actif de GLMS et de GFPT2, ou entraver l'activité des deux enzymes en formant des liaisons de coordination avec leurs sites actifs.

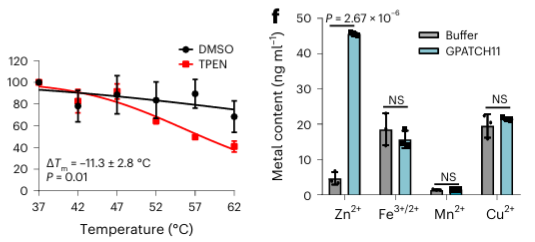
4. Le chélateur de métaux TPEN peut reconnaître spécifiquement les protéines de liaison aux ions zinc.
Enfin, les chercheurs ont étendu la capacité de METAL-TPP à identifier les protéines liant les métaux dans les protéines humaines à l’aide du chélateur de métaux TPEN. Les résultats expérimentaux ont révélé que parmi les 150 protéines présentant une stabilité thermique réduite, 110 (73 %) étaient des protéines connues se liant aux métaux, ce qui indique que le TPEN, comme l'EDTA, peut reconnaître spécifiquement les protéines se liant aux métaux. Parmi celles-ci, 95 (86 %) des protéines connues liant les métaux étaient des protéines liant les ions zinc, tandis que seulement 41 % des protéines présentant une stabilité thermique réduite causée par l'EDTA étaient des protéines liant les ions zinc, ce qui suggère la préférence de TPEN pour l'identification des ions zinc. -des protéines de liaison.
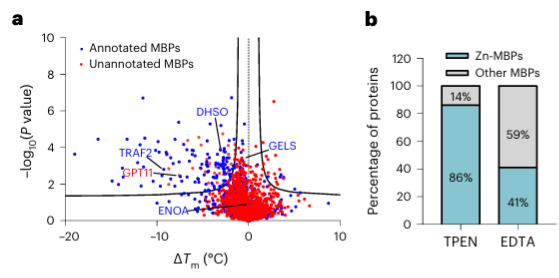
Parmi les 40 protéines potentielles de liaison aux métaux identifiées, les auteurs ont sélectionné une protéine cible, GPATCH11, pour une validation biochimique préliminaire et ont découvert que cette protéine est une protéine de liaison aux ions zinc.
5. Comparaison de la capacité de reconnaissance de deux chélateurs de métaux dans METAL-TPP.
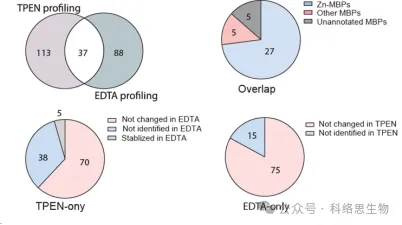
Les chercheurs ont également comparé la capacité de deux chélateurs de métaux, le TPEN et l'EDTA, à identifier des protéines présentant une stabilité thermique réduite dans les données protéomiques METAL-TPP. Ils ont découvert que parmi les 37 protéines identifiées par les deux chélateurs, 27 étaient connues pour se lier au zinc, 5 pour se lier à d’autres métaux et 5 n’étaient auparavant pas annotées en tant que protéines liant les métaux. Pour les protéines dont la stabilité thermique a diminué sous un chélateur et est restée inchangée ou a augmenté sous l'autre, les chercheurs ont suggéré deux raisons possibles pour expliquer la différence dans la plage d'identification par METAL-TPP. Premièrement, chaque chélateur peut agir comme un ligand de liaison dans certaines protéines, les rendant plus stables et neutralisant l’effet déstabilisant provoqué par la liaison des métaux. Deuxièmement, en raison de leurs structures moléculaires différentes, les deux chélateurs ont également une solubilité dans l’eau très différente. Ainsi, les futures études METAL-TPP pourront être réalisées en utilisant d’autres chélateurs dotés de structures moléculaires uniques pour explorer de manière plus complète la portée du métalloprotéome.
Dans l’ensemble, cette étude a introduit une nouvelle méthode, METAL-TPP, qui constitue un outil puissant pour mener des études protéomiques de liaison aux métaux. Grâce à cette approche, les chercheurs ont systématiquement identifié les protéines liant les métaux et élucidé leurs rôles dans les fonctions biologiques et la pathogenèse. Cet effort établit non seulement d'importantes bases de données, mais fournit également des informations précieuses pour comprendre les fonctions biochimiques et le potentiel de développement de médicaments des protéines liant les métaux, favorisant ainsi la poursuite des recherches dans des domaines connexes.

