Dévoiler le mystère de la petite molécule WA : faire la lumière sur la régulation de l'enzyme PHGDH et ouvrir la voie à de nouvelles thérapies anticancéreuses
La sérine, acide aminé indispensable, remplit diverses fonctions biologiques cruciales au sein des organismes vivants. Il sert non seulement de composant fondamental dans la synthèse des protéines, mais participe également à la régulation de nombreuses voies métaboliques, notamment la synthèse des nucléotides, le métabolisme de la méthionine et les fonctions antioxydantes. Parmi ces voies, la phosphopyruvate déshydrogénase (PHGDH) revêt une importance cruciale car elle catalyse l'étape initiale de la voie de synthèse de la sérine, convertissant le 3-phosphoglycérate en 3-phosphohydroxypyruvate. Compte tenu de son rôle central dans le métabolisme de la sérine, toute aberration de la fonction de la PHGDH est intimement liée à l’apparition et à la progression de nombreuses maladies, notamment le cancer.
Cet article présente une approche innovante qui utilise des techniques de protéomique chimique et d’analyse phénotypique pour identifier un composé capable d’inhiber de manière covalente la PHGDH. Alors que la plupart des inhibiteurs de la PHGDH sont généralement de nature compétitive, les auteurs présentent la withangulatine A (WA), une petite molécule naturelle, comme un nouvel inhibiteur covalent de la PHGDH. WA apparaît comme un composé prometteur pour le développement d’inhibiteurs de la PHGDH. De plus, WA constitue une sonde précieuse pour étudier la fonctionnalité de PHGDH et la voie de synthèse de la sérine (SSP). En tirant parti de cet inhibiteur, les chercheurs acquièrent des connaissances plus approfondies sur les mécanismes de régulation régissant le métabolisme de la sérine, ouvrant ainsi la voie à l'exploration de modalités de traitement potentielles pour des maladies associées, notamment le cancer.
Cette découverte offre non seulement des orientations prometteuses pour le développement de nouvelles stratégies de traitement médicamenteux, mais fournit également des informations cruciales sur le rôle du métabolisme de la sérine dans la progression de la maladie.
Itinéraire de recherche
Processus expérimental
1. Comparaison de WP et WA dans les expériences de cytotoxicité.
Dans l’étude, l’auteur a conçu et synthétisé une sonde composée appelée WP. En utilisant des cellules humaines de cancer du côlon (HCT-116) et des cellules normales du côlon (NCM460), les auteurs ont observé que WP présentait une cytotoxicité comparable à celle de WA. Ceci suggère que l’inclusion de marqueurs alcynes n’a pas modifié de manière significative ses effets cytotoxiques. En outre, les auteurs ont noté que WA présentait une cytotoxicité plus faible dans les cellules normales du côlon mais une cytotoxicité plus élevée dans les cellules cancéreuses du côlon, soulignant sa sélectivité accrue envers les cellules cancéreuses du côlon.
Par la suite, les auteurs ont utilisé une stratégie de profilage des protéines basée sur l'activité (ABPP), utilisant la sonde WP dans les cellules HCT-116. Cette approche a conduit à l’identification de PHGDH comme protéine cible directe de WA. La validation expérimentale a été réalisée à l'aide de tests WB-pull down, confirmant les résultats.
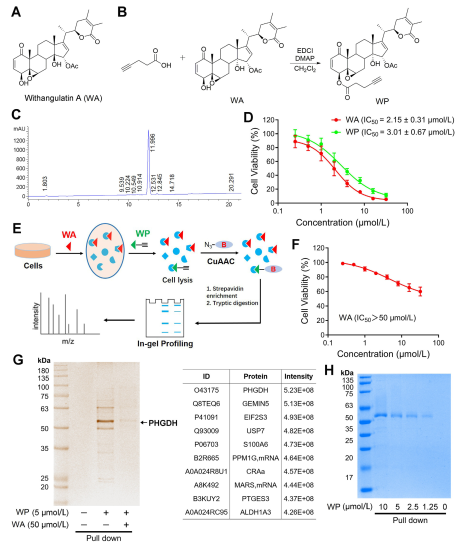
Figure 1 : Approche protéomique chimique pour identifier les cibles de la withangulatine A.
2. Confirmation de l'interaction directe entre WA et PHGDH.
En utilisant la technologie ABPP (Activity-Based Protein Profiling), les auteurs ont identifié PHGDH comme une cible directe du composé WA dans les cellules HCT-116. Pour valider l’interaction entre WA et PHGDH, les auteurs ont mené des expériences sur la stabilité de la cible sensible à l’affinité des médicaments (DARTS) et le test de déplacement thermique cellulaire (CETSA). Les résultats ont démontré que WA améliorait la stabilité thermique du PHGDH et inhibait de manière significative son activité. De plus, les expériences d'interférométrie de biocouche (BLI) ont fourni une confirmation supplémentaire de l'interaction directe entre WA et PHGDH.
Les auteurs ont également étudié la nature irréversible de la liaison de WA au PHGDH. Leurs expériences ont révélé que PHGDH empêchait la liaison du WP ; cependant, la préincubation avec des solutions contenant de la N-acétylcystéine (NAC) ou du glutathion (GSH) pourrait inverser la liaison du WP au PHGDH. Ces résultats suggèrent une liaison covalente irréversible entre les résidus WA et cystéine dans la protéine PHGDH.
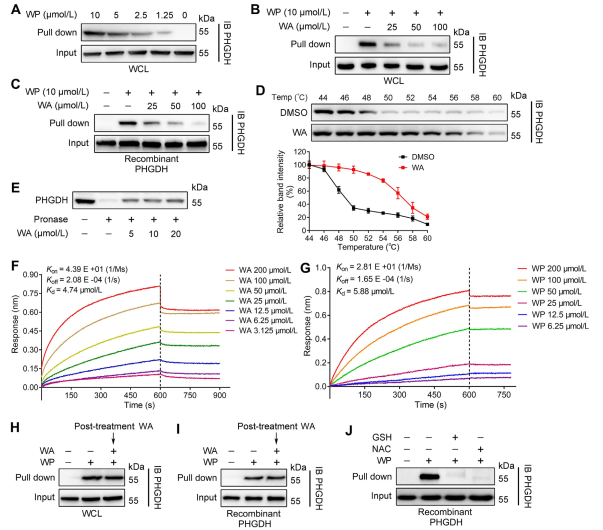
Figure 2 : WA se lie directement à PHGDH.
3. WA se lie de manière covalente à PHGDH via le fragment cétone α - β -insaturé.
Pour élucider davantage le mécanisme par lequel WA interagit avec PHGDH, les chercheurs ont mené des expériences pour confirmer la liaison covalente de WA à PHGDH via sa structure cétonique α-β-insaturée. Initialement, les fragments de cétones α, β-insaturés de WA ont été réduits pour produire WA-1 (voir la partie figure 3A). Des analyses ultérieures utilisant les tests Cell Counting Kit-8 (CCK-8) et les tests d'interaction protéique Pull-down (voir Figure 3B) ont démontré que l'effet cytotoxique de WA dépendait en effet de sa structure cétonique α et β-insaturée. À l'inverse, WA-1 n'a pas réussi à empêcher efficacement la liaison du PHGDH au WP (voir les figures 3C et D), confirmant ainsi la liaison covalente de la cétone β-insaturée au PHGDH (voir la figure 3E).
Compte tenu du rôle important de l'inhibition ou de l'absence de PHGDH dans le blocage des processus de la voie de synthèse de la sérine (SSP) dans les cellules tumorales, les auteurs ont étudié l'effet du WA sur l'activité de la SSP dans les cellules HCT-116 en utilisant le marquage isotopique stable de l'U-13C-glucose (voir à la figure 3J). Les résultats expérimentaux ont révélé que WA inhibait efficacement l’activité SSP dans les cellules HCT-116.
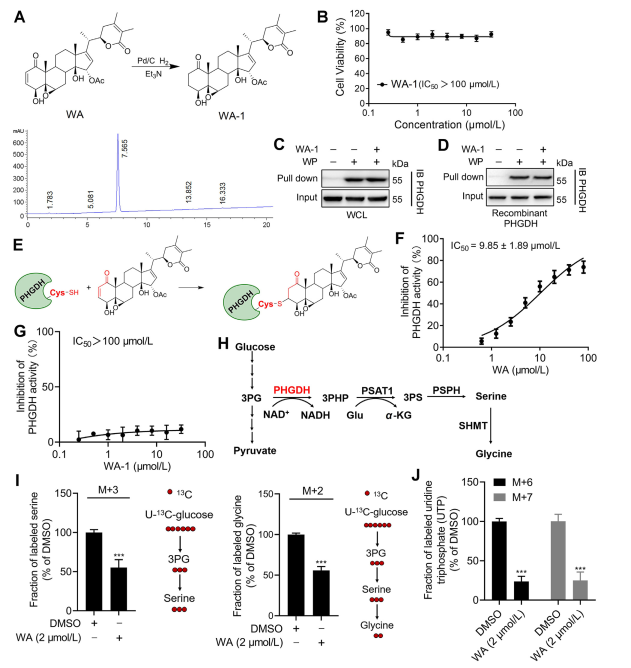
Figure 3 : WA se lie de manière covalente à PHGDH et inhibe l’activité de PHGDH.
4. Le résidu Cys295 de PHGDH est lié de manière covalente à WA.
Théoriquement, les fragments cétones α et β-insaturés de WA peuvent former une liaison covalente avec les résidus cystéine de la protéine. En effet, les auteurs ont observé une modification covalente des résidus Cys295 dans PHGDH par WA. Par la suite, ils ont fourni des preuves supplémentaires de la liaison covalente de WA aux résidus Cys295 de PHGDH et ont démontré que les mutations au niveau de Cys295 réduisaient de manière significative l'activité inhibitrice de WA sur PHGDH. De plus, les expériences d'interférométrie de biocouche (BLI) n'ont révélé aucune interaction entre WA et la protéine recombinante Cys295A PHGDH, confirmant la liaison covalente sélective de WA à PHGDH.
De plus, des simulations de dynamique moléculaire ont indiqué que WA fonctionne comme un régulateur allostérique de PHGDH, le résidu Cys295 servant potentiellement de nouveau site allostérique pour PHGDH.
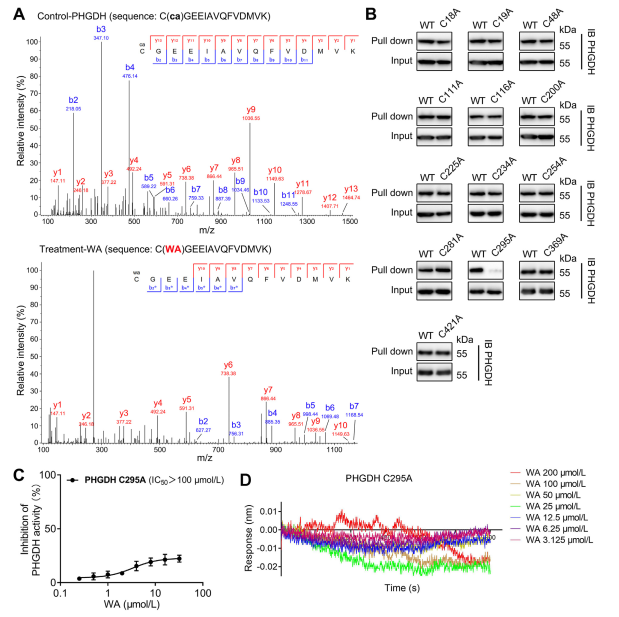
Figure 4. WA Se lie de manière sélective et covalente aux résidus Cys295 de PHGDH.
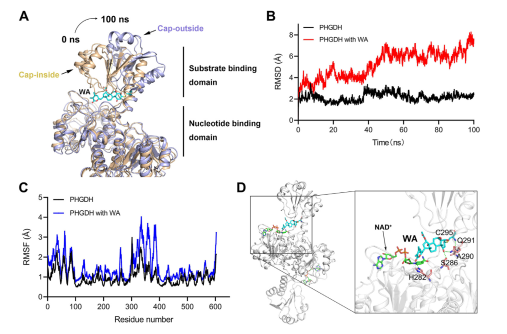
Figure 5 : Résidu Cys295 en tant que site de régulation allostérique du PHGDH
5. L'effet de WA sur l'équilibre redox dans les cellules HCT-116.
La voie de synthèse de la sérine (SSP) joue un rôle central dans le maintien de l'équilibre rédox cellulaire en fournissant des précurseurs pour la synthèse du glutathion (GSH) et la production de NADPH, essentiels aux réactions rédox. Les auteurs ont étudié l’impact du WA sur l’équilibre redox dans les cellules HCT-116 et ont observé que le WA entraînait une augmentation des niveaux d’espèces réactives de l’oxygène (ROS), réduisant ainsi les ratios GSH/GSSG et NADPH/NADP+, ce qui indique un stress oxydatif accru.
L'analyse par Western blot a révélé une expression élevée de γ H2AX, de la caspase3 clivée et de PARP clivée, ainsi qu'une diminution de l'expression de CHK2 et de la cycline D1, suggérant l'induction de l'apoptose par WA. De plus, la perte de PHGDH a entraîné une augmentation de la production de ROS, une prolifération inhibée des cellules HCT-116 et une réduction de la cytotoxicité de WA dans les cellules à faible expression de PHGDH. Ces résultats soulignent le rôle du PHGDH dans la production de ROS et la cytotoxicité médiée par WA dans les cellules HCT-116.
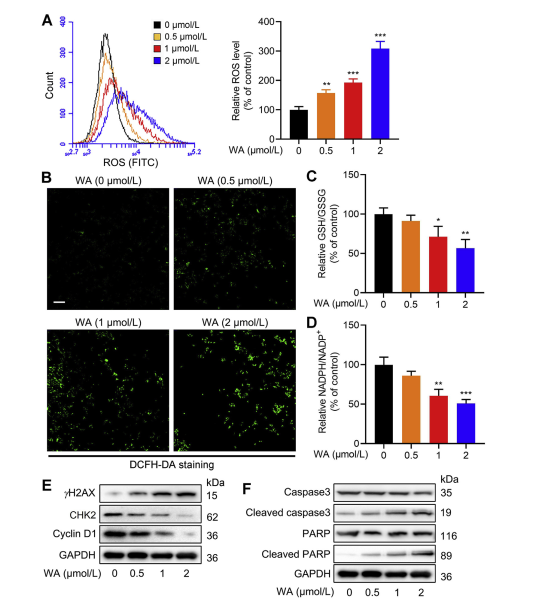
Figure 6 : WA augmente les niveaux de ROS intracellulaires dans les cellules HCT-116
6. Effet de prolifération cellulaire dans les modèles de xénogreffe.
Pour évaluer l'impact du WA sur la prolifération des cellules HCT-116 in vivo, les auteurs ont établi un modèle de xénogreffe utilisant des cellules HCT-116. Les résultats ont révélé que WA ne présentait aucun effet significatif sur le poids corporel ou la morphologie des organes, ce qui indique une faible toxicité.
Pour étudier plus en détail la sélectivité de WA pour l’inhibition de la PHGDH, les auteurs ont généré un modèle de xénogreffe en utilisant des cellules HCT116 knock-out (KO) de PHGDH. Dans ce modèle, l'absence de PHGDH a nettement inhibé la prolifération des cellules HCT-116 (voir Figure 7, AC). De plus, l'expression de Ki67, un marqueur de la prolifération cellulaire, a été significativement réduite dans le modèle de xénogreffe cellulaire PHGDH KO HCT116 (voir Figure 7, D).
Notamment, dans le modèle de xénogreffe utilisant des cellules PHGDH KO HCT-116, WA n'a démontré aucun effet inhibiteur significatif sur la prolifération cellulaire (voir la figure 7, EG), confirmant en outre que l'effet inhibiteur de WA sur les cellules HCT-116 dépendait de PHGDH.
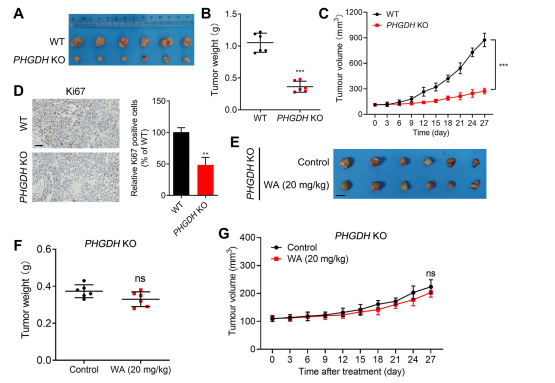
Figure 7 : Effet du WA sur la prolifération des cellules PHGDH KO HCT-116 in vivo
Les résultats de cette étude fournissent non seulement des indices clés pour le développement futur de médicaments anticancéreux pour le PHGDH, mais apportent également de nouveaux espoirs et un nouveau potentiel pour le développement de nouveaux médicaments dans le domaine du traitement du cancer.

