L'analisi ABPP rivela un nuovo meccanismo antinfiammatorio dell'acido itaconico attraverso le interazioni proteina-metabolita
Il suo ruolo è stato chiarito in un documento congiunto del team di ChomiX Biotech in merito all'itaconato, un metabolita endogeno cruciale per l'infiammazione e la regolazione immunitaria. Lo studio ha utilizzato in modo innovativo la tecnologia ABPP per rivelare che l’itaconato modifica la S-glicosilazione dei residui di cisteina sugli enzimi glicolitici chiave, influenzando così il metabolismo cellulare. I ricercatori hanno mappato le interazioni proteina-itaconato, scoprendo che l'itaconato lega e regola direttamente più enzimi nel percorso della glicolisi, influenzandone la velocità e la direzione. Questa ricerca fa avanzare la nostra conoscenza dei meccanismi di controllo metabolico durante l'infiammazione correlata alla malattia e dimostra la forza dell'ABPP nell'esplorare il modo in cui le piccole molecole modulano le funzioni delle proteine. In qualità di leader nella proteomica chimica, Corolus BioScience offre soluzioni complete, tra cui la progettazione della sonda, l'elaborazione dei campioni, lo screening ad alto rendimento e l'analisi dei dati, per aiutare i clienti a scoprire meccanismi di regolazione metabolica simili.
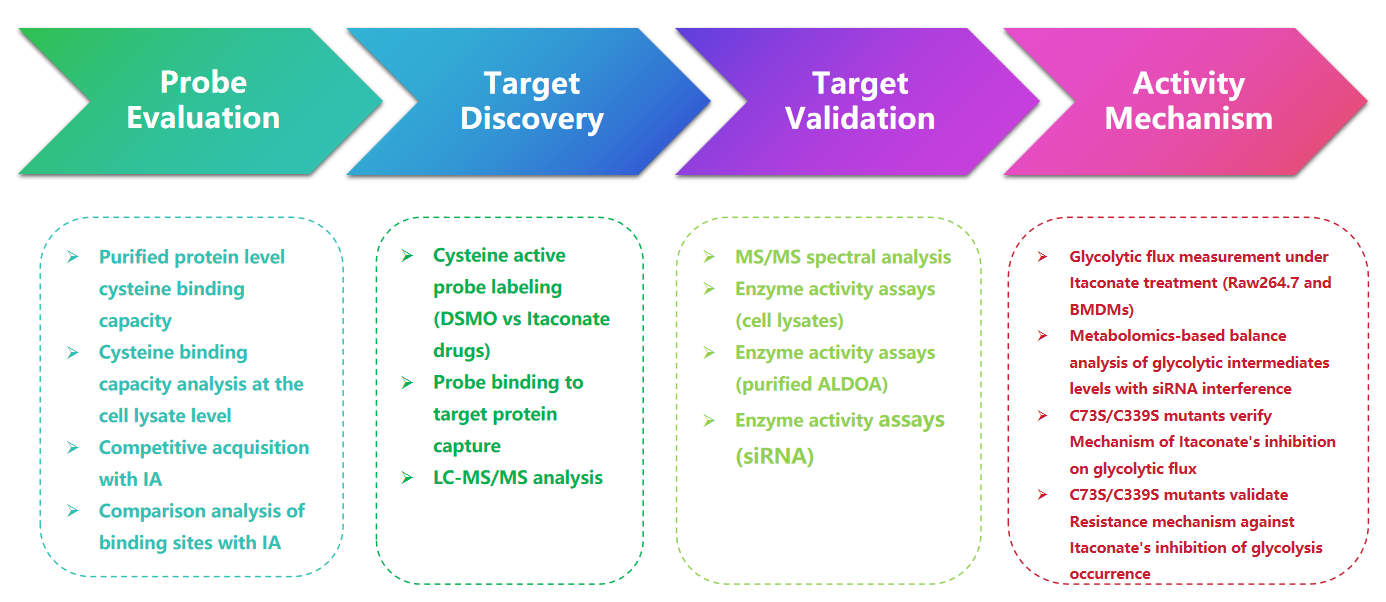
1. Rilevazione delle modifiche dell'itaconato con la sonda 1-OH-Az
In questo studio, gli autori hanno utilizzato tecniche avanzate di profilazione per studiare i residui di cisteina mirati all'itaconato. Inizialmente hanno valutato la sonda 1-OH-Az mediante elettroforesi su gel e hanno eseguito esperimenti competitivi utilizzando IA-alchino. La convalida della spettrometria di massa ha confermato che 1-OH-Az etichetta selettivamente i siti della cisteina, con l'87% delle proteine appena identificate non precedentemente documentate come proteine leganti il ligando in DrugBank. Date le diverse funzioni e la rilevanza patologica di queste proteine, la sonda 1-OH-Az può essere utilizzata per identificare le cisteine attive come potenziali bersagli farmacologici per nuove terapie.
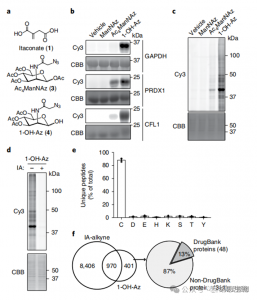
Figura 1: 1-OH-Az come sonda efficiente e distintiva per l'analisi della cisteina per il rilevamento delle modifiche dell'itaconato
2. Identificazione dei siti di modificazione dell'itaconato utilizzando tecniche di proteomica quantitativa
I ricercatori hanno condotto esperimenti isoTOP-ABPP per quantificare i residui di cisteina modificati dall'itaconato utilizzando la sonda 1-OH-Az. Dopo il pretrattamento del lisato, è stata utilizzata la proteomica quantitativa assistita da linker marcata isotopicamente per analizzare l'impatto di diverse concentrazioni di itaconato, individuando i suoi obiettivi specifici. Sono stati condotti anche esperimenti comparativi utilizzando due concentrazioni di IA-alchino che, pur mostrando un'attività e una copertura più ampie, hanno riconosciuto solo 65 e 50 siti concorrenti effettivi. In particolare, 1-OH-Az ha dimostrato un vantaggio competitivo significativamente più elevato tra le cisteine co-quantificate.
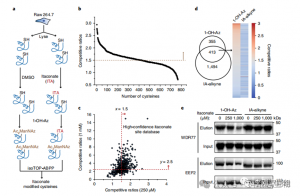
Figura 2: Analisi chimica proteomica delle cisteine modificate con itaconato utilizzando isoTOP-ABPP competitivo con 1-OH-Az
3. Itaconato modifica e inibisce un enzima glicolitico chiave
L'analisi spettrometrica di massa ha rivelato che l'itaconato modifica tre enzimi glicolitici chiave: ALDOA, GAPDH e LDHA. La modificazione endogena dell'itaconato su Cys73 e Cys339 di ALDOA è stata confermata all'interno delle cellule Raw264.7 stimolate con LPS. A causa della loro vicinanza, gli autori hanno ipotizzato che tali modifiche potrebbero influenzare l’attività dell’aldolasi. Infatti, il trattamento con itaconato 1 mM ha portato ad una ridotta attività dell'enzima ALDOA senza influenzare l'espressione proteica. Inoltre, le analisi isoTOP-ABPP hanno mostrato che anche Cys84 su LDHA e Cys245 su GAPDH sono bersagli per la modificazione dell'itaconato.

Figura 3: Itaconate può modificare e compromettere la funzione ALDOA
4. L'itaconato sopprime principalmente la glicolisi prendendo di mira l'ALDOA
Per valutare il ruolo regolatorio di ITAC nella glicolisi infiammatoria dei macrofagi, gli autori hanno monitorato il consumo di glucosio e la produzione di lattato nelle cellule Raw264.7 prima e dopo la stimolazione con LPS, dimostrando che ITAC ha ridotto significativamente entrambi, indicando la soppressione della funzione glicolitica. Per convalidare l'effetto di ITAC su ALDOA e la successiva inibizione della glicolisi, hanno abbattuto l'ALDOA endogeno utilizzando RNAi e hanno sovraespresso WT o ALDOA doppio mutante (C73S/C339S) nelle cellule Raw264.7. Come previsto, l'abbattimento di ALDOA ha comportato una diminuzione del consumo di glucosio e della produzione di lattato, rendendo le cellule insensibili al trattamento ITAC. La reintroduzione di WT o ALDOA mutante ha ripristinato i livelli metabolici nelle cellule non trattate; tuttavia, le cellule che sovraesprimono l'ALDOA mutante hanno mostrato una sensibilità ridotta all'inibizione glicolitica rispetto al WT. Saggi enzimatici per l'attività dell'aldolasi allineati con gli stati glicolitici.
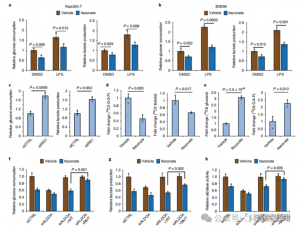
Figura 4: Itaconate altera il percorso glicolitico modificando ALDOA
5. L'inibizione di ALDOA contribuisce alle risposte antinfiammatorie
Questi risultati hanno svelato che ITAC sopprime l'attività della via glicolitica modificando i residui di cisteina Cys73 e Cys339 su ALDOA. Gli autori hanno inoltre dedotto dalla nota azione antinfiammatoria del dimetilfumarato attraverso la modificazione della cisteina sul GAPDH e l'inibizione glicolitica che ITAC può similmente fornire un feedback per interferire con la glicolisi ed esercitare un effetto antinfiammatorio. L'abbattimento di ALDOA ha ridotto significativamente la secrezione di IL-1β dopo stimolazione con LPS, suggerendo il suo coinvolgimento nella regolazione dell'infiammazione attraverso la glicolisi. La parziale inversione degli effetti antinfiammatori dell’ALDOA con piruvato integrato ha indicato un ruolo limitato dell’LDHA nelle risposte infiammatorie.
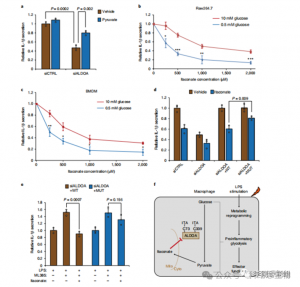
Figura 5: L'azione antinfiammatoria dell'itaconato è mediata dalla sua inibizione dell'ALDOA, con conseguente interruzione della glicolisi
In sintesi, questo articolo ha sfruttato in modo efficace le tecnologie di profilazione della cisteina basate sulla S-glicosilazione e le metodologie ABPP per costruire una rete di interazioni tra itaconato e proteine correlate. Dimostra in modo convincente che l’itaconato funge da regolatore metabolico critico modificando specificamente i residui di cisteina sulle proteine per controllare la via glicolitica. Questa ricerca non solo chiarisce il meccanismo d’azione dell’itaconato come nuovo regolatore metabolico, ma fornisce anche prove solide di come i piccoli metaboliti interagiscono con le proteine per modulare le vie metaboliche principali.
Oltre all'ABPP, altri metodi per studiare le interazioni tra metaboliti di piccole molecole e proteine includono, ma non sono limitati a:
1. Arricchimento di affinità (pull-down)tecniche, in cui il composto nativo viene convertito in una sonda biotinilata che incuba con lisati cellulari, seguita da arricchimento mediato da streptavidina e isolamento di bersagli proteici che si legano alla sonda di biotina.
2.Spettrometria di massa a proteolisi limitata (LiP-MS)è una tecnologia di scoperta del target basata sull'affinità proteica. Quando ligandi specifici, come farmaci o piccole molecole, si legano a particolari proteine, inducono cambiamenti conformazionali o ostacoli sterici che portano a siti di clivaggio differenziali rispetto alla proteina non legata. Rilevando queste differenze utilizzando la spettrometria di massa, questo metodo può identificare le interazioni farmaco-proteina all'interno delle cellule e determinare i bersagli molecolari del farmaco.
3.Saggio di spostamento termico cellulare (CETSA)è stato inizialmente sviluppato per aiutare nella ricerca sui bersagli dei farmaci antitumorali ed è uno dei primi metodi senza etichetta ampiamente utilizzati per studiare il coinvolgimento dei farmaci target nelle cellule intatte. CETSA si basa principalmente sul principio che legandosi a una proteina bersaglio, un composto aumenta la sua stabilità termica. Dopo aver incubato i campioni con il composto e i controlli corrispondenti a vari gradienti di temperatura, le proteine legate al ligando rimangono ripiegate e relativamente stabili dopo il riscaldamento, mentre le proteine non legate si dispiegano e precipitano a causa della denaturazione. La successiva analisi della termostabilità delle proteine solubili mediante approcci basati sull'immunoblotting o sulla spettrometria di massa, in base alle loro curve di fusione, conferma l'interazione tra il composto e le proteine intracellulari.
4. Cromatografia di affinitàcomporta la coniugazione del metabolita bersaglio con una matrice in fase solida per catturare i complessi proteici che interagiscono con esso. Le proteine catturate vengono quindi identificate utilizzando tecniche come la spettrometria di massa.
5.Risonanza plasmonica di superficie (SPR)viene utilizzato per la misurazione in tempo reale e senza etichetta dei parametri cinetici associati alle interazioni tra piccole molecole e proteine.
6. Cristallografia delle proteinechiarisce le strutture tridimensionali delle proteine complessate con ligandi di piccole molecole, fornendo una visione intuitiva dei siti di legame e dei meccanismi d'azione. Risolvendo queste strutture, i ricercatori possono visualizzare direttamente come le piccole molecole interagiscono con i loro bersagli proteici.

