Utilizzo della proteomica chimica per identificare il bersaglio funzionale SLC25A20 dell'Ingenol Mebutato per la cheratosi attinica
Questo studio utilizza la proteomica chimica per svelare un nuovo bersaglio del macromorolo metil butilato (Ing-Meb), un farmaco impiegato nel trattamento della cheratosi solare. Il gruppo di ricerca ha inizialmente ideato e sintetizzato una sonda di fotoaffinità Ing-Meb denominata Ing-Dayne, che forma legami covalenti con proteine bersaglio in seguito all'esposizione alla luce UV, facilitando l'identificazione di potenziali bersagli funzionali. Attraverso la successiva validazione, gli autori hanno identificato SLC25A20 come bersaglio fondamentale di Ing-Meb. SLC25A20 è una traslocasi della carnitina-acilcarnitina legata alla membrana mitocondriale coinvolta nel metabolismo degli acidi grassi. In particolare, l'azione inibitoria di Ing-Meb sulla funzione SLC25A20 porta ad un aumento dell'accumulo di acilcarnitine a catena lunga, dimostrando che Ing-Meb suscita i suoi effetti terapeutici modulando la via di ossidazione degli acidi grassi. Inoltre, lo studio approfondisce l'importanza delle modifiche strutturali nelle indagini sui prodotti naturali. Sintetizzando la sonda di fotoaffinità Ing-Dayne attraverso la modifica strutturale di Ing-Meb, i ricercatori sono riusciti a portare alla luce un nuovo bersaglio distinto dalla comprensione convenzionale. Ciò non solo migliora la comprensione di Ing-Meb e della sua modalità di azione, ma sottolinea anche il ruolo fondamentale della modifica strutturale nella ricerca di proteomica chimica per svelare le complessità dei prodotti naturali. Tali intuizioni stimolano ulteriormente l’innovazione dei farmaci, comprendendo l’ottimizzazione dell’efficacia dei farmaci esistenti, lo sviluppo di nuove terapie mirate a entità specifiche e la delucidazione dei meccanismi degli effetti collaterali dei farmaci.
Itinerario di ricerca
Processo sperimentale
1. La progettazione della sonda sintetica di fotoaffinità Ing-Dayne svela il meccanismo alla base del legame del farmaco Ing-Meb per la cheratosi attinica alla sua proteina bersaglio.
In questo studio è stata impiegata la sonda di affinità Ing Ing-Dayne, derivata dal farmaco terapeutico per la cheratosi attinica Ing-Meb (fare riferimento alla Figura 1). Attraverso la co-coltura di questa molecola sonda con cellule specifiche e la successiva irradiazione con luce UV, la doppia struttura di acridina all'interno della sonda ha formato legami covalenti stabili con le proteine intracellulari. Dopo la lisi cellulare, una reazione chimica Click ha facilitato l'attacco del gruppo reporter azide-tetrametilrodamina alla proteina bersaglio (come illustrato nella Figura 2). La successiva analisi SDS-PAGE (illustrata nella Figura 3) ha rivelato che Ing-Meb ha mostrato un significativo effetto di legame competitivo sulla sonda, mentre Ingenol, possedendo una struttura simile, non ha dimostrato inibizione competitiva.
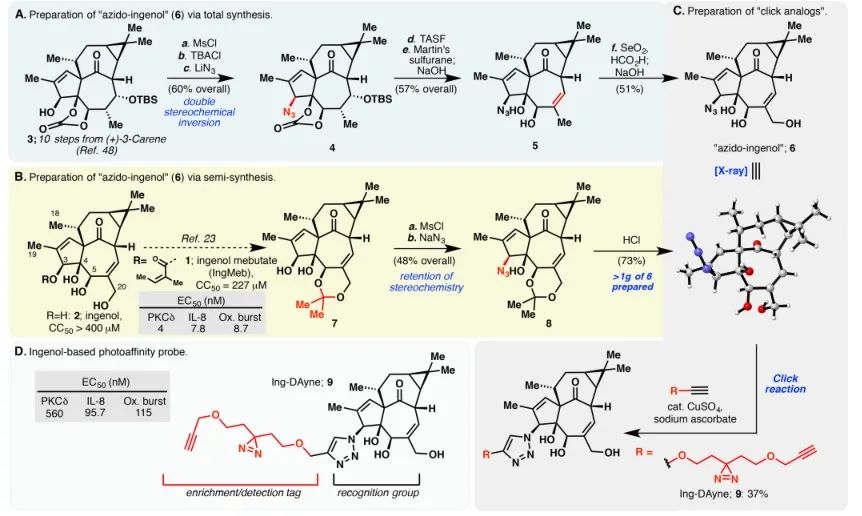
Figura 1: Illustra le due vie sintetiche impiegate per la sintesi di Ing-Dayne.
2. La nuova sonda 11b ha identificato 44 proteine bersaglio di BBR correlate all'infiammazione all'interno delle cellule THP-1 e ha rivelato EIF2AK2, eEF1A1, PRDX3 e VPS4B come bersagli diretti con interazioni specifiche con BBR.
Gli autori, attraverso una serie di esperimenti, hanno utilizzato con successo la nuova sonda 11b per marcare e purificare potenziali proteine bersaglio all'interno delle cellule THP-1. Successivamente, hanno utilizzato l’analisi LC-MS/MS per identificare 44 proteine associate all’infiammazione nell’intervallo di peso molecolare compreso tra 20 e 80 kDa, tra le quali sei hanno scoperto di svolgere un ruolo potenzialmente critico nelle azioni antinfiammatorie di BBR. In ulteriori indagini, EIF2AK2, eEF1A1, PRDX3 e VPS4B sono stati confermati come bersagli diretti di BBR, mostrando effetti di inibizione competitiva ad alte concentrazioni di trattamento con BBR. Questa scoperta ha rivelato la probabile esistenza di interazioni specifiche tra queste proteine e BBR, chiarendo così nuove informazioni sul loro coinvolgimento con il farmaco durante i suoi processi antinfiammatori.
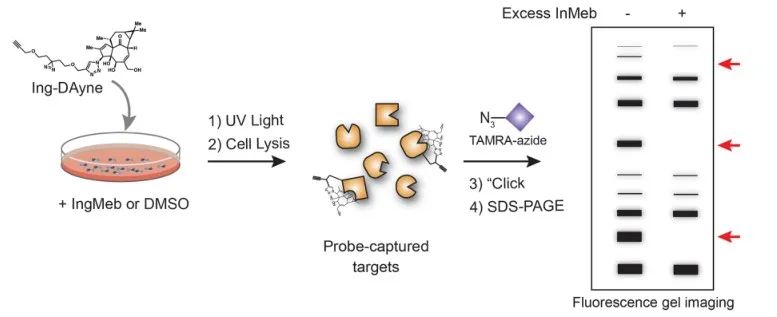
Figura 2: Processo di validazione basato su gel del target Ing-Dayne.
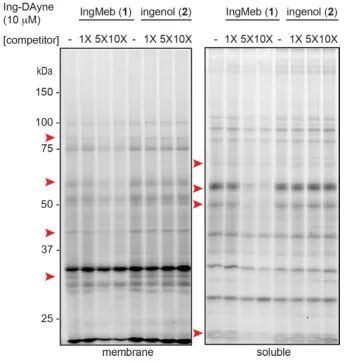
Figura 3: Inibizione competitiva di Ing-Meb e ingenolo sulla molecola sonda Ing-Dayne.
3. Lo screening SILAC, combinato con la validazione Western blot, ha identificato SLC25A20 come bersaglio primario del farmaco Ingenol-class Ing-Meb.
Gli autori hanno inizialmente esaminato 28 potenziali proteine bersaglio utilizzando la tecnologia SILAC (Stable Isotope Labeling by Amino Acids in Cell Culture) (Figura 4). Successivamente, attraverso ulteriori screening ed esperimenti di validazione Western blot (Figura 5), i ricercatori hanno osservato che Ing-Meb mostrava il più forte effetto inibitorio su SLC25A20 tra questi target candidati, suggerendo fortemente che SLC25A20 è uno dei principali target funzionali di Ing-Meb.
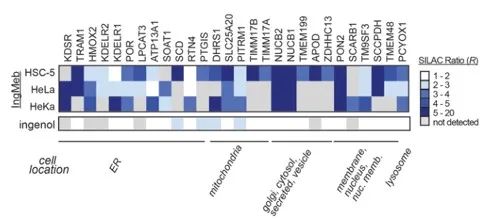
Figura 4: I 28 potenziali target ottenuti dallo screening iniziale.
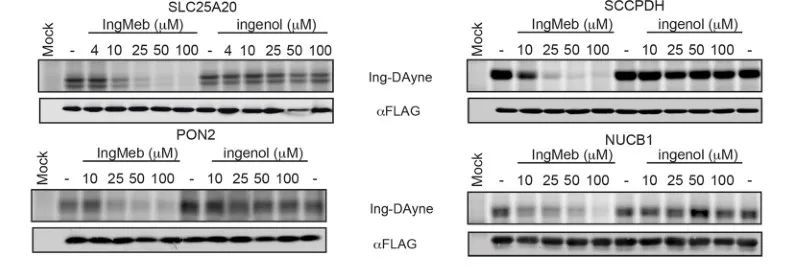
Figura 5: Esperimenti Western blot di quattro potenziali proteine bersaglio.
4. Ing-Meb regola la via di ossidazione degli acidi grassi inibendo SLC25A20, una proteina della membrana mitocondriale nota anche come alcalilipoiltransferasi botulinica, rivelando così il suo bersaglio come farmaco per la cheratosi attinica.
Gli autori hanno studiato SLC25A20, nota anche come lipoiltransferasi alcalina botulinica o CACT, una proteina integrale multimodale di membrana localizzata all'interno della membrana mitocondriale. La sua funzione primaria prevede il trasporto delle acilcarnitine a catena lunga nei mitocondri, facilitandone lo scambio con la carnitina libera. Queste acilcarnitine trasportate vengono successivamente convertite in acilCoA grasso dalla carnitina palmitoiltransferasi-2 (CPT-2), fungendo così da precursori per la β-ossidazione degli acidi grassi. I risultati sperimentali hanno rivelato un aumento significativo del contenuto cellulare di acilcarnitina a catena lunga con concentrazioni crescenti del farmaco per la cheratosi attinica Ing-Meb (raffigurato nella Figura 6). Questa osservazione supporta fortemente l'effetto inibitorio di Ing-Meb su SLC25A20, confermando così SLC25A20 come uno dei principali bersagli che mediano l'azione di Ing-Meb.
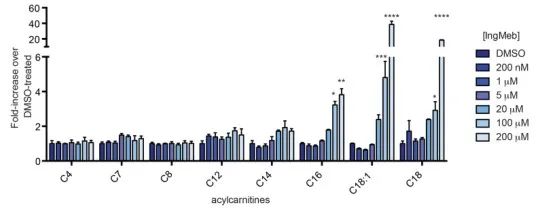
Figura 6: Effetto di Ing-Meb per le acilcarnitine a catena lunga
5. Convalida indiretta dell'effetto citotossico di Ing-Meb tramite l'espressione SLC25A20: rivelazione della sua funzione target nella regolazione dell'attività dei farmaci.
I ricercatori hanno cercato di collegare direttamente l'inibizione di SLC25A20 nelle cellule HeLa con i potenziali effetti citotossici di Ing-Meb. I risultati hanno indicato che mentre la sovraespressione di SLC25A20 non ha alterato la metà della concentrazione inibitoria di Ing-Meb in queste cellule, è interessante notare che l'aumento dell'espressione di SLC25A20 ha mitigato significativamente l'impatto di Ing-Meb sull'accumulo di acilcarnitina a catena lunga (illustrato nella Figura 7) . Questo risultato conferma ulteriormente l’ipotesi che SLC25A20 funge da bersaglio funzionale fondamentale per l’attività farmacologica di Ing-Meb.
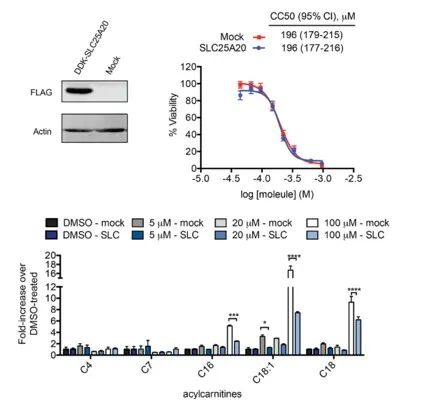
Figura 7: Effetto dell'espressione o meno di SLC25A20 su CC50 e acilcarnitina.
Questo studio non solo rivela i nuovi obiettivi di Ing-Meb, ma fornisce anche una nuova base teorica e una direzione strategica per la scoperta di prodotti naturali strutturalmente complessi. Riferimento:
Riferimento:https://doi.org/10.1021/acscentsci.7b00420.

