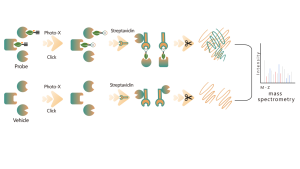Prodotti
Analisi omica delle modifiche post-traduzionali della cisteina
La cisteina, con la sua notevole reattività, svolge un ruolo fondamentale nella struttura e nella funzione delle proteine. Fungendo da reagente nucleofilo, centro catalitico redox, ligando di ioni metallici e sito chiave per i cambiamenti conformazionali, partecipa ampiamente e influenza profondamente l'attività proteica e i meccanismi regolatori. Vale la pena notare che i residui di cisteina sono inclini a subire vari tipi di modifiche post-traduzionali (PTM), che non solo regolano finemente le proprietà funzionali delle proteine, ma possono anche portare a compromissioni funzionali. Data la stretta associazione di tali modifiche con numerose importanti malattie umane, l'analisi qualitativa e quantitativa dei PTM della cisteina nelle proteine è di fondamentale importanza. Ciò ha un valore indispensabile per una comprensione approfondita delle funzioni biologiche delle proteine rilevanti e dei loro meccanismi d'azione negli stati di salute e di malattia.
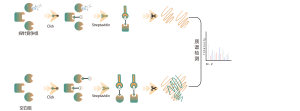
Chomix ha una vasta esperienza nell'identificazione delle modificazioni della cisteina, come la persulfidazione della cisteina. Utilizzando in modo innovativo sonde universali per cisteina basate sulla differenza di pKa tra -SH e -SSH, regoliamo il pH per ridurre l'interferenza di fondo da -SH, consentendo alle sonde di etichettare prevalentemente -SSH e quindi identificare efficacemente i siti di solfenilazione.
Chomix possiede una tecnologia avanzata di spettrometria di massa in grado di risolvere direttamente e accuratamente vari tipi di modifiche post-traduzionali delle proteine e i loro siti specifici. Attraverso l'integrazione intelligente delle tecniche di separazione e arricchimento con l'etichettatura isotopica e altri metodi avanzati, consentiamo analisi qualitative e quantitative su larga scala e ad alto rendimento di varie modifiche, fornendo un solido supporto tecnico per la ricerca approfondita sulle modifiche post-traduzionali delle proteine.

I nostri vantaggi
1. Competenza professionale: con una vasta esperienza e pubblicazioni su riviste leader, offriamo servizi su misura per risultati ottimali.
2. Gestione rigorosa della qualità: i nostri sistemi di qualità maturi aderiscono agli standard ISO9001, garantendo rapporti affidabili.
3. Servizio completo: dalla progettazione della sonda all'analisi bioinformatica, forniamo consulenza tutto in uno fino alla consegna, con aggiornamenti tempestivi sui progressi.
4. Attrezzature avanzate: dotati di spettrometri di massa all'avanguardia come Thermo Fisher Orbitrap Exploris 480 e Bruker timsTOF, supportiamo la ricerca rivoluzionaria.
Il nostro servizio
| Progetto | Analisi omica delle modifiche post-traduzionali della cisteina |
| Campione | Proteine pure, lisato cellulare, cellule vive, tessuto malato, sangue, batteri, tessuto vegetale |
| Piattaforma hardware | Polverizzatore di cellule ad ultrasuoni senza contatto, sistema di imaging ChemiDoc MP, spettrometro di massa Orbitrap Fusion Lumos Tribrid/Orbitrap Exploris 480/Q Exactive HF-X/timsTOF Pro 2 |
| Durata del progetto | 4-8 settimane |
| Risultati finali | Rapporto di progetto (comprese procedure sperimentali, grafici di analisi dei dati, risultati di analisi bioinformatica) |
| Prezzo | Clicca per consultare |
Caso di studio
La tiolazione si riferisce all'accoppiamento di un gruppo tiolico (-SSH) ai residui di cisteina nelle proteine, mediato dall'idrogeno solforato (H2S). Per studiare ulteriormente questo processo, interi proteomi possono essere estratti da campioni di cellule o tessuti ed etichettati utilizzando un metodo con sonda chimica (sonda specifica per la cisteina). A differenza dell'interferenza tiolica, questo metodo consente un'efficace marcatura dei gruppi tiolici regolando con precisione il pH. Successivamente, con l'aiuto della spettrometria di massa ad alta risoluzione, i ricercatori possono identificare con precisione i siti di tiolazione, chiarendo così ulteriormente l'importante ruolo di questa modificazione post-traduzionale in vivo.
Utilizzando modelli di cellule HeLa, è stato prima estratto l'intero proteoma. Successivamente, la modellazione con NaHS e la regolazione del pH hanno consentito un'accurata etichettatura dei gruppi tiolici mediante una sonda universale per cisteina. Attraverso una serie di passaggi tra cui arricchimento, digestione enzimatica e rilevamento mediante spettrometria di massa, sono stati identificati 180 peptidi contenenti modifiche -SSH, insieme a 120 proteine correlate, inclusi i siti di tiolazione segnalati GAPDH_C152 e C247.

Ecco gli spettri MS/MS dei peptidi con modifiche -SSH: