
Prodotti
Scoperta chemioproteomica di nuove strutture di piombo per bersagli non farmacologici
Contesto tecnico
Attualmente, solo circa 800 proteine sono state prese di mira da farmaci approvati dalla FDA, e un gran numero di bersagli correlati alle malattie sono “non trattabili”. Perché, attualmente, la maggior parte delle tecnologie si basa su proteine purificate. L'avvento della chemproteomica ha rivoluzionato la scoperta di farmaci dalle proteine purificate alle cellule viventi. È in grado di analizzare quantitativamente le interazioni tra piccole molecole e proteine nella scala del proteoma umano. Ora la scoperta di strutture covalenti contro specifici residui amminoacidici di proteine bersaglio, come cisteina, lisina, metionina e tirosina, è stata dimostrata nei lisati cellulari e nelle cellule viventi. ChomiX sfrutterà la propria piattaforma di chemioproteomica per superare rapidamente le barriere degli obiettivi “non resistenti”.

Vantaggi tecnici
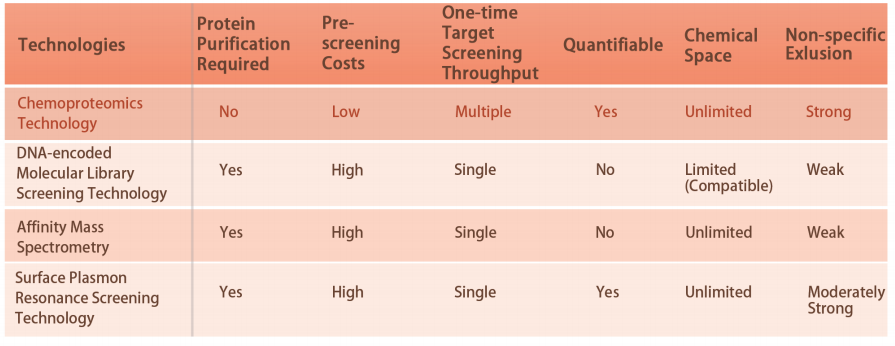
Caratteristiche tecniche della piattaforma
La piattaforma DIA-ABPP è progettata per scoprire leganti covalenti che coinvolgono bersagli proteici attraverso le reazioni covalenti con il gruppo tiolico dei residui di cisteina. Una volta che i residui attivi di cisteina delle proteine saranno occupati preferenzialmente da molecole covalenti, verrà contesa la marcatura della sonda universale che reagisce specificatamente con il gruppo tiolico. In combinazione con tecniche di proteomica quantitativa basate su DIA, è stato possibile quantificare le intensità dei peptidi marcati con sonda tra la molecola covalente e il gruppo di controllo. Queste differenze di segnale rappresentano i tassi di occupazione delle molecole covalenti contro le loro proteine leganti. A differenza delle tradizionali strategie di screening a bersaglio singolo, la piattaforma DIA-ABPP consente l'analisi quantitativa delle interazioni tra frammenti elettrofili e quasi tutte le proteine nelle cellule viventi con la risoluzione dei residui di aminoacidi, che migliora notevolmente l'efficienza e riduce il rischio per il progetto di scoperta di strutture di piombo ad alto rendimento .

Flusso di lavoro dello screening dei composti di piombo covalenti
Caratteristica 1

La nostra libreria di molecole simili a farmaci contiene una varietà di gruppi reattivi (testate) caratterizzati da lieve reattività elettrofila come acrilammide, cloroacetamide e alchinamide. Queste molecole presentano farmacofori strutturalmente diversi conformi alla regola del cinque di Lipinski.
Caratteristica 2

Attualmente, la libreria di target proteici catturati dalla sonda chimica tiolo-specifica copre 39962 siti di cisteina da 12421 proteine, tra cui chinasi, fosfatasi, ligasi e fattori di trascrizione. La biblioteca rimane continuamente aggiornata, garantendo l'accesso alle informazioni più recenti su target e siti specifici. Informazioni dettagliate su obiettivi e siti specifici sono disponibili tramite il collegamento sottostante.
Caratteristica 3

In un singolo esperimento di screening, la piattaforma è in grado di quantificare l'impegno target di piccole molecole (A2-H6) contro tutte le proteine marcate nell'intero proteoma. La figura sopra mostra l'occupazione del sito di bersagli clinicamente importanti selezionati da parte di molecole covalenti. Più scuro è il colore, maggiore è l'occupazione delle molecole nelle tasche di legame, compresi i siti ortosterici e allosterici (l'asterisco indica che il tasso di occupazione è superiore all'80%). Pertanto, l'affinità e la selettività di ciascuna molecola possono essere valutate simultaneamente per la successiva ottimizzazione della struttura.




