[Finanziamento nazionale di progetti chiave] Svelare le proteine che legano i metalli: scoperte METAL-TPP e innovazioni nella scoperta di farmaci
Le proteine che legano i metalli sono componenti cruciali che formano complessi stabili con ioni metallici, svolgendo varie funzioni vitali negli organismi viventi, tra cui la segnalazione cellulare, la catalizzazione di reazioni biochimiche e il mantenimento dell'omeostasi degli ioni metallici. La loro disregolazione è associata a malattie come il cancro, disturbi neurologici e malattie metaboliche. Comprendere il loro ruolo nella patogenesi della malattia è fondamentale per la diagnosi e il trattamento. Inoltre, le proteine che legano i metalli sono obiettivi importanti nello sviluppo dei farmaci, poiché molti farmaci interagiscono con esse per esercitare effetti terapeutici. In questo studio, i ricercatori hanno introdotto METAL-TPP, un metodo di proteomica chimica all'avanguardia. Combinando l'analisi proteomica quantitativa della termostabilità (TPP) con l'identificazione delle proteine che legano i metalli, METAL-TPP consente il rilevamento efficiente e accurato delle proteine che legano i metalli. In particolare, regola la termostabilità delle proteine utilizzando una gamma di chelanti metallici, facilitando l'identificazione precisa nelle proteine pure e nei lisati cellulari. Questo approccio innovativo offre nuove conoscenze sulla funzione e sui meccanismi delle proteine che legano i metalli, aiutando la ricerca biologica, la comprensione delle malattie e lo sviluppo di farmaci. Keloxi Biology fornisce ABPP avanzati, TPP e altri servizi tecnici nella ricerca e sviluppo farmaceutico, supportando i ricercatori nell'esplorazione dei meccanismi dei farmaci e nell'avanzamento dei processi di sviluppo di nuovi farmaci.

Processo sperimentale
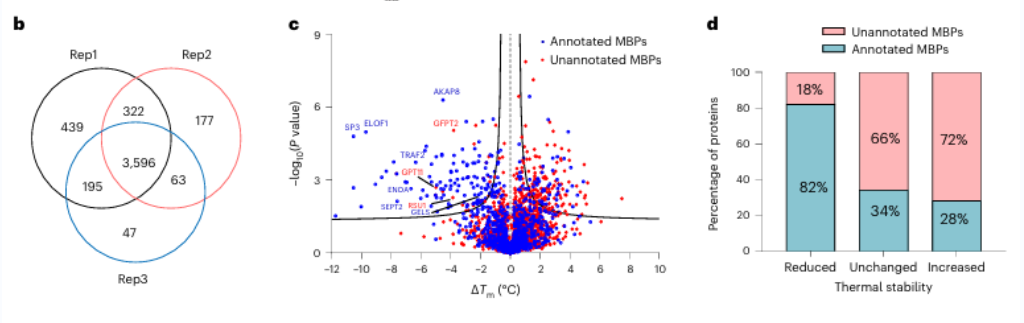
1. Diciassette potenziali proteine leganti i metalli sono state identificate utilizzando METAL-TPP.
Inizialmente, i ricercatori hanno valutato l'efficacia della chelazione dei metalli ad ampio spettro utilizzando EDTA su proteine pure e lisati cellulari. Hanno osservato che METAL-TPP ha rilevato efficacemente le riduzioni della stabilità termica delle proteine che legano i metalli. Successivamente, è stata condotta un'analisi sistematica sulle proteine di derivazione umana utilizzando METAL-TPP, identificando 125 proteine che mostravano una ridotta termostabilità. Tra queste, 102 erano proteine precedentemente note che legano i metalli. Inoltre, sono state scoperte 17 potenziali proteine che legano i metalli senza previa annotazione funzionale, offrendo nuove informazioni sul ruolo delle proteine che legano i metalli.
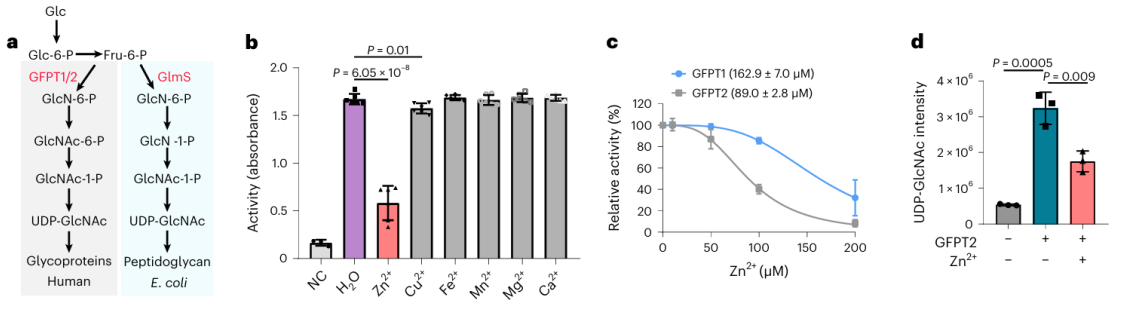
2. L'effetto degli ioni zinco sulla potenziale proteina legante i metalli GFPT2.
Tra queste 17 potenziali proteine che legano i metalli, i ricercatori hanno scelto di condurre una convalida biochimica approfondita sulla proteina GFPT2. GFPT1/2 funge da primo enzima limitante la velocità nella via della biosintesi dell'esoso, favorendo la generazione di una sostanza chiamata UDP-GlcNAc. I ricercatori hanno confermato a livello cellulare che gli ioni zinco interagiscono con GFPT2, inibendone l'attività. Inoltre, hanno osservato che la presenza di ioni zinco porta a una riduzione significativa dei livelli di UDP-GlcNAc, indicando che gli ioni zinco regolano la via della biosintesi dell’esoso inibendo l’attività di GFPT2. È interessante notare che gli ioni zinco mostrano una diversa selettività nell'inibire le attività di GFPT2 e GFPT1, suggerendo la presenza di un nuovo meccanismo di regolazione.
3. Decifrare il meccanismo molecolare degli ioni zinco sull'attività degli enzimi GFPT2 e GLMS.
I ricercatori hanno isolato l'omologo della proteina GFPT2 da E. coli e hanno proceduto con una serie di esperimenti biochimici e analisi della struttura cristallina. I risultati hanno rivelato che la proteina GLMS ha la capacità di legare gli ioni zinco e, in particolare, questo legame avviene vicino alla regione di legame del substrato. Ciò suggerisce un potenziale scenario in cui gli ioni zinco potrebbero competere per legarsi al sito attivo di GLMS e GFPT2, o ostacolare l’attività di entrambi gli enzimi formando legami di coordinazione con i loro siti attivi.

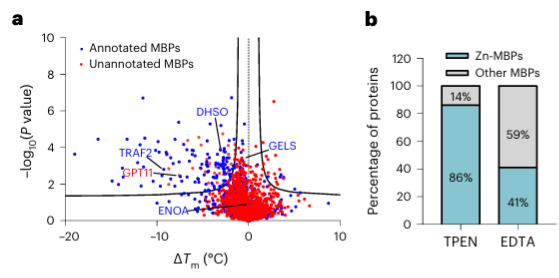
4. Il chelante metallico TPEN può riconoscere specificamente le proteine che legano gli ioni zinco.
Infine, i ricercatori hanno esteso la capacità di METAL-TPP di identificare le proteine che legano i metalli nelle proteine umane utilizzando il chelante dei metalli TPEN. I risultati sperimentali hanno rivelato che tra le 150 proteine con stabilità termica ridotta, 110 (73%) erano proteine note che legano i metalli, indicando che TPEN, come EDTA, può riconoscere specificamente le proteine che legano i metalli. Tra queste, 95 (86%) delle proteine note che legano i metalli erano proteine che legavano gli ioni zinco, mentre solo il 41% delle proteine con ridotta stabilità termica causata dall'EDTA erano proteine che legavano gli ioni zinco, suggerendo la preferenza di TPEN per l'identificazione degli ioni zinco -proteine leganti.
Tra le 40 potenziali proteine leganti i metalli identificate, gli autori hanno selezionato una proteina bersaglio, GPATCH11, per la convalida biochimica preliminare e hanno scoperto che questa proteina è una proteina legante gli ioni zinco.
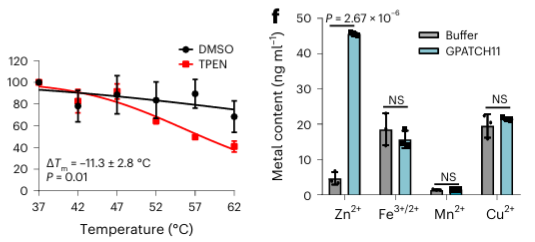
5. Confronto della capacità di riconoscimento di due chelanti metallici in METAL-TPP.
I ricercatori hanno anche confrontato la capacità di due chelanti metallici, TPEN ed EDTA, di identificare proteine con stabilità termica ridotta nei dati proteomici METAL-TPP. Hanno scoperto che tra le 37 proteine identificate da entrambi i chelanti, 27 erano note per legare lo zinco, 5 erano note per legare altri metalli e 5 non erano precedentemente annotate come proteine leganti i metalli. Per le proteine la cui stabilità termica diminuiva sotto un chelante e rimaneva invariata o aumentava sotto l'altro, i ricercatori hanno suggerito due possibili ragioni per la differenza nell'intervallo di identificazione mediante METAL-TPP. Innanzitutto, ciascun chelante può agire come un ligando legante in alcune proteine, rendendole più stabili e contrastando l'effetto destabilizzante causato dal legame del metallo. In secondo luogo, a causa delle diverse strutture molecolari, i due chelanti hanno anche solubilità in acqua molto diverse. Pertanto, i futuri studi METAL-TPP possono essere eseguiti utilizzando altri chelanti con strutture molecolari uniche per esplorare in modo più completo la portata del metalloproteoma.
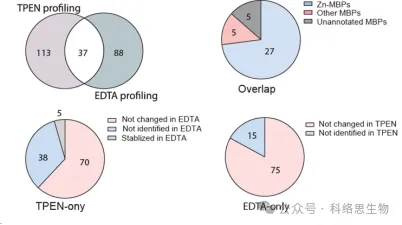
Nel complesso, questo studio ha introdotto un nuovo metodo, METAL-TPP, che funge da potente strumento per condurre indagini di proteomica che lega i metalli. Attraverso questo approccio, i ricercatori hanno identificato sistematicamente le proteine che legano i metalli e hanno chiarito il loro ruolo nelle funzioni biologiche e nella patogenesi. Questo sforzo non solo crea importanti database, ma fornisce anche preziose informazioni per comprendere le funzioni biochimiche e il potenziale di sviluppo di farmaci delle proteine che legano i metalli, promuovendo così ulteriori ricerche in campi correlati.
Riferimento:,https://www.nature.com/articles/s41589-024-01563-y.

