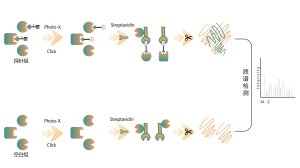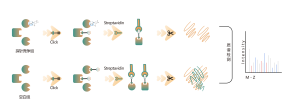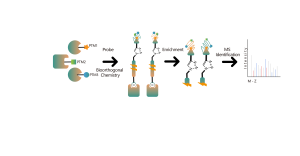Prodotti
Analisi quantitativa dell'occupazione e della selettività dei bersagli farmacologici a piccole molecole covalenti
I farmaci covalenti funzionano principalmente formando legami covalenti con specifici residui di aminoacidi su proteine bersaglio, come cisteina, lisina e serina. L’aspirina è una delle prime molecole farmacologiche covalenti conosciute. Inoltre, molti prodotti naturali presentano proprietà covalenti, come l’oridonina, che ha una bioattività antinfiammatoria. Negli ultimi anni, i farmaci mirati covalenti hanno guadagnato una crescente attenzione da parte delle aziende farmaceutiche. Ad oggi, la FDA ha approvato almeno sei farmaci covalenti mirati alle chinasi, incluso ibrutinib, che prende di mira la chinasi BTK.
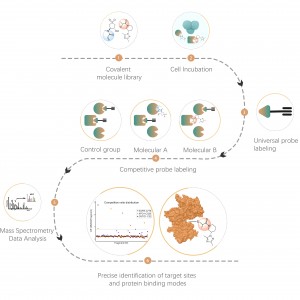
Nella scoperta di bersagli farmacologici covalenti in cellule o tessuti, una strategia efficace è la modifica chimica di piccole molecole attive introducendo gruppi reporter (come biotina o gruppi bioortogonali). Questa modifica, pur mantenendo l'attività originale della molecola, consente la cattura diretta di bersagli proteici interagenti nelle cellule o nei tessuti vivi. Tuttavia, molte molecole attive sono difficili da modificare chimicamente, oppure i prodotti formati dopo la reazione con residui di amminoacidi sono instabili, il che li rende inadatti al rilevamento tramite spettrometria di massa. Per superare queste sfide, ChomiX offre una soluzione: l’identificazione del sito di modifica utilizzando l’etichettatura competitiva con sonde specifiche per gli aminoacidi.
Piattaforma tecnica
La nostra piattaforma tecnologica è incentrata su una sonda chimica universale specifica per gli aminoacidi. Quando una piccola molecola attiva reagisce con un residuo amminoacidico e occupa il sito di legame, questa sonda chimica universale genera una differenza significativa di segnale per quel sito di legame rispetto ai campioni di controllo in bianco. Rilevando queste differenze nei segnali di etichettatura, possiamo ottenere con precisione informazioni sulle proteine bersaglio e sui residui amminoacidici della molecola attiva, comprese sia le proteine attese (sul bersaglio) che quelle potenziali fuori bersaglio. Questa piattaforma tecnologica fornisce un solido supporto per la scoperta di target di farmaci covalenti e la ricerca sui meccanismi d'azione dei farmaci.

I nostri vantaggi
1. Eccellenza tecnica: team esperto, pubblicazioni su riviste di alto livello e servizi di settore autorevoli.
2. Tecnologia brevettuale di base: brevetti esclusivi e hardware avanzato per il supporto iniziale allo sviluppo di farmaci.
3. Servizio unico: copre la progettazione della sonda, la sintesi, la scoperta del target, l'analisi bioinformatica e il feedback tempestivo sui progressi per la soddisfazione del cliente.
4. Rigorosa gestione della qualità: la certificazione ISO9001 garantisce rapporti affidabili e autentici.
Il nostro servizio
| Progetto | Analisi quantitativa dell'occupazione e della selettività dei bersagli farmacologici a piccole molecole covalenti |
| Campione | Proteine pure, lisato cellulare, cellule vive, tessuto malato, sangue, batteri, tessuto vegetale |
| Piattaforma hardware | Polverizzatore di cellule ad ultrasuoni senza contatto, sistema di imaging ChemiDoc MP, spettrometro di massa Orbitrap Fusion Lumos Tribrid/Orbitrap Exploris 480/Q Exactive HF-X/timsTOF Pro 2 |
| Durata del progetto | 2-4 settimane |
| Risultati finali | Rapporto di progetto (comprese procedure sperimentali, grafici di analisi dei dati, risultati di analisi bioinformatica) |
| Prezzo | Clicca per consultare |
Caso di studio
AMG510, sviluppato da Amgen, è il primo farmaco mirato al mondo per i tumori mutanti KRAS-G12C. Questo progetto mira a verificare la specificità e la selettività del bersaglio nelle corrispondenti cellule mutanti. Utilizzando la piattaforma DIA-ABPP di Chomix, abbiamo analizzato in modo completo gli obiettivi covalenti di AMG510 nelle cellule fino al livello dei residui di amminoacidi.
I dati sperimentali mostrano che in quattro esperimenti ripetuti su cellule NCI-H358, sono stati analizzati sistematicamente un totale di 16.992 residui di cisteina da 5.768 proteine. Sotto il trattamento con 1μM AMG510, il sito KRAS_C12 ha mostrato cambiamenti significativi, mentre KRAS_C80 è rimasto inalterato, fornendo una forte prova dell'elevata specificità di AMG510 verso il sito mutante KRAS-G12C (contrassegnato con un asterisco che indica il sito del residuo di cisteina target).