Svelare il mistero della piccola molecola WA: far luce sulla regolazione degli enzimi PHGDH e aprire la strada a nuove terapie antitumorali
La serina, un amminoacido indispensabile, svolge varie funzioni biologiche cruciali all'interno degli organismi viventi. Non solo funge da componente fondamentale nella sintesi proteica, ma partecipa anche alla regolazione di numerose vie metaboliche, tra cui la sintesi dei nucleotidi, il metabolismo della metionina e le funzioni antiossidanti. Tra questi percorsi, la fosfopiruvato deidrogenasi (PHGDH) riveste un significato fondamentale poiché catalizza la fase iniziale della via di sintesi della serina, convertendo il 3-fosfoglicerato in 3-fosfoidrossipiruvato. Dato il suo ruolo centrale nel metabolismo della serina, qualsiasi aberrazione nella funzione PHGDH è strettamente legata all’insorgenza e alla progressione di numerose malattie, in particolare del cancro.
Questo articolo introduce un approccio innovativo che utilizza tecniche di proteomica chimica e analisi fenotipica per identificare un composto in grado di inibire covalentemente il PHGDH. Sebbene la maggior parte degli inibitori del PHGDH siano tipicamente di natura competitiva, gli autori presentano la Withangulatina A (WA), una piccola molecola naturale, come un nuovo inibitore covalente del PHGDH. WA emerge come un promettente composto guida per lo sviluppo di inibitori del PHGDH. Inoltre, WA funge da preziosa sonda per studiare la funzionalità di PHGDH e la via di sintesi della serina (SSP). Sfruttando questo inibitore, i ricercatori ottengono informazioni più approfondite sui meccanismi regolatori che governano il metabolismo della serina, aprendo così strade per esplorare potenziali modalità di trattamento per le malattie correlate, in particolare il cancro.
Questa scoperta non solo offre indicazioni promettenti per lo sviluppo di nuove strategie di trattamento farmacologico, ma fornisce anche informazioni cruciali sul ruolo del metabolismo della serina nella progressione della malattia.
Itinerario di ricerca
Processo sperimentale
1. Confronto tra WP e WA negli esperimenti di citotossicità.
Nello studio, l'autore ha ideato e sintetizzato una sonda composta denominata WP. Impiegando cellule di cancro del colon umano (HCT-116) e cellule normali del colon (NCM460), gli autori hanno osservato che il WP mostrava una citotossicità paragonabile a WA. Ciò suggerisce che l'inclusione di marcatori alchinici non ha alterato in modo significativo i suoi effetti citotossici. Inoltre, gli autori hanno notato che WA mostrava una citotossicità inferiore nelle cellule normali del colon ma una citotossicità maggiore nelle cellule tumorali del colon, sottolineando la sua maggiore selettività verso le cellule tumorali del colon.
Successivamente, gli autori hanno utilizzato una strategia di profilazione proteica basata sull'attività (ABPP), utilizzando la sonda WP nelle cellule HCT-116. Questo approccio ha portato all'identificazione di PHGDH come proteina bersaglio diretta di WA. La validazione sperimentale è stata effettuata utilizzando saggi WB-pull down, confermando i risultati.
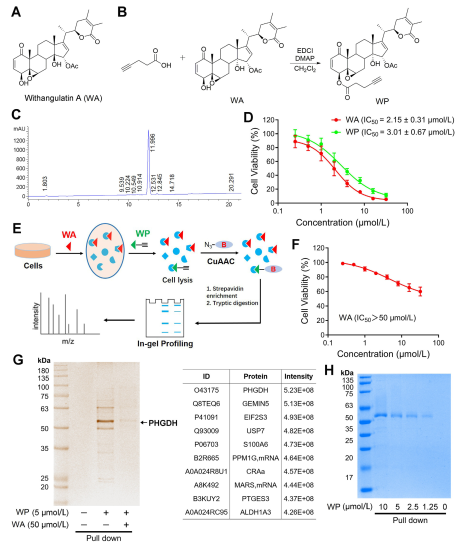
Figura 1: Approccio della proteomica chimica per identificare gli obiettivi della witangulatina A.
2. Conferma dell'interazione diretta tra WA e PHGDH.
Utilizzando la tecnologia ABPP (Activity-Based Protein Profiling), gli autori hanno identificato PHGDH come bersaglio diretto del composto WA nelle cellule HCT-116. Per convalidare l'interazione tra WA e PHGDH, gli autori hanno condotto esperimenti DARTS (Drug Affinity Responsive Target Stability) e Cellular Thermal Shift Assay (CETSA). I risultati hanno dimostrato che WA ha migliorato la stabilità termica del PHGDH e ha inibito significativamente la sua attività. Inoltre, gli esperimenti di interferometria del biostrato (BLI) hanno fornito un'ulteriore conferma dell'interazione diretta tra WA e PHGDH.
Gli autori hanno anche studiato la natura irreversibile del legame del WA con PHGDH. I loro esperimenti hanno rivelato che PHGDH ha impedito il legame del WP; tuttavia, la preincubazione con soluzioni contenenti N-acetil cisteina (NAC) o glutatione (GSH) potrebbe invertire il legame di WP con PHGDH. Questi risultati suggeriscono un legame covalente irreversibile tra WA e residui di cisteina nella proteina PHGDH.
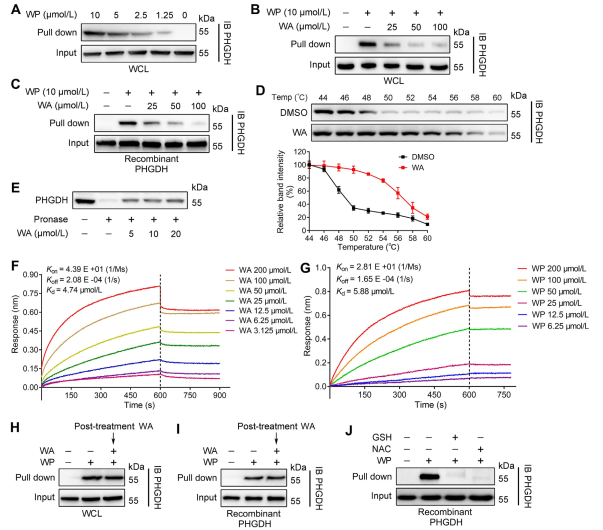
Figura 2: WA si lega direttamente a PHGDH.
3. WA si lega covalentemente a PHGDH tramite la porzione chetonica α - β -insatura.
Per chiarire ulteriormente il meccanismo con cui WA interagisce con PHGDH, i ricercatori hanno condotto esperimenti per confermare il legame covalente di WA con PHGDH attraverso la sua struttura chetonica α-β-insatura. Inizialmente, i frammenti chetonici α,β-insaturi di WA sono stati ridotti per produrre WA-1 (fare riferimento alla Parte Figura 3A). Analisi successive utilizzando i test Cell Counting Kit-8 (CCK-8) e i test di interazione proteica Pull-down (fare riferimento alla Figura 3B) hanno dimostrato che l'effetto citotossico di WA dipendeva effettivamente dalla sua struttura chetonica α e β-insatura. Al contrario, WA-1 non è riuscito a prevenire efficacemente il legame di PHGDH a WP (fare riferimento alle Figure 3C e D), confermando così ulteriormente il legame covalente del chetone β-insaturo a PHGDH (fare riferimento alla Figura 3E).
Dato il ruolo significativo dell'inibizione o dell'assenza di PHGDH nel bloccare i processi della via di sintesi della serina (SSP) nelle cellule tumorali, gli autori hanno proceduto a studiare l'effetto di WA sull'attività SSP nelle cellule HCT-116 utilizzando l'etichettatura dell'isotopo stabile U-13C-glucosio (fare riferimento alla Figura 3J). I risultati sperimentali hanno rivelato che WA ha inibito efficacemente l'attività SSP nelle cellule HCT-116.
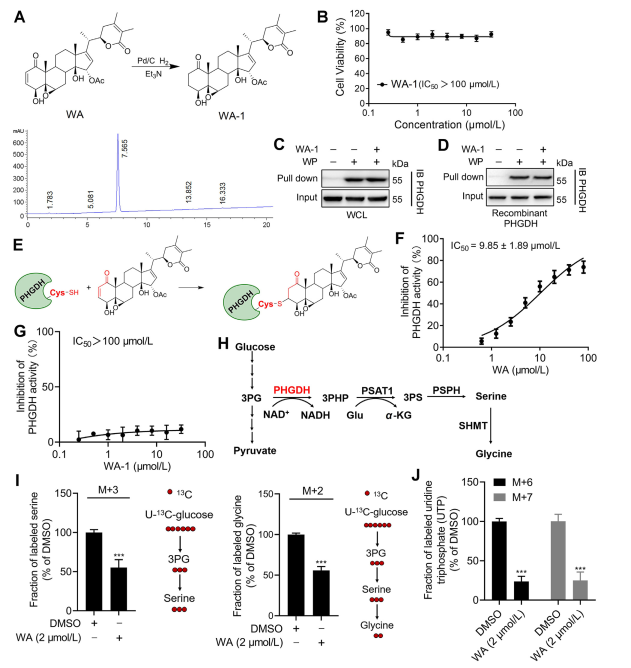
Figura 3: WA si lega covalentemente al PHGDH e inibisce l'attività del PHGDH.
4. Il residuo Cys295 di PHGDH è legato covalentemente a WA.
Teoricamente, le porzioni chetoniche α e β-insature di WA possono formare un legame covalente con i residui di cisteina della proteina. In effetti, gli autori hanno osservato la modifica covalente dei residui Cys295 in PHGDH da parte di WA. Successivamente, hanno fornito ulteriori prove del legame covalente di WA ai residui Cys295 di PHGDH e hanno dimostrato che le mutazioni di Cys295 riducevano significativamente l'attività inibitoria di WA su PHGDH. Inoltre, gli esperimenti di Biolayer Interferometry (BLI) non hanno rivelato alcuna interazione tra WA e la proteina ricombinante Cys295A PHGDH, confermando il legame covalente selettivo di WA a PHGDH.
Inoltre, simulazioni di dinamica molecolare hanno indicato che WA funziona come un regolatore allosterico di PHGDH, con il residuo Cys295 che potenzialmente funge da nuovo sito allosterico per PHGDH.
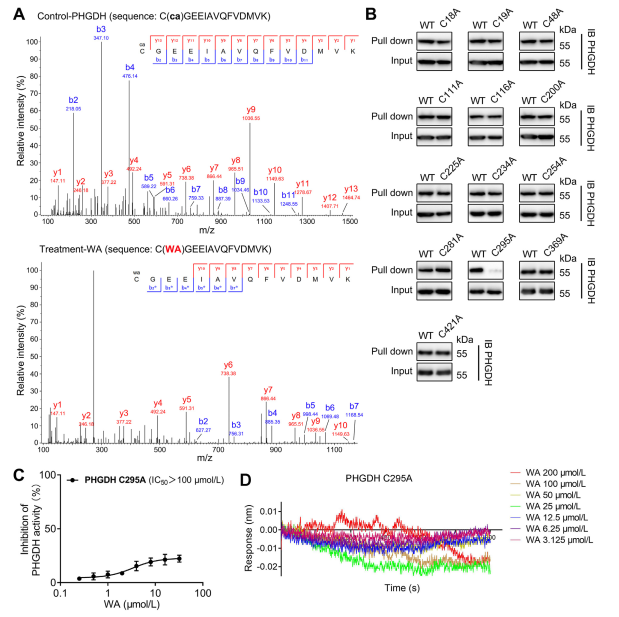
Figura 4. WA si lega selettivamente in modo covalente ai residui Cys295 di PHGDH.
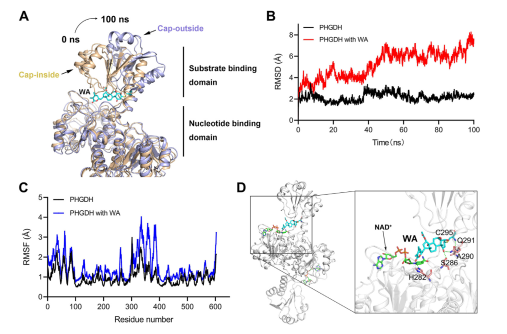
Figura 5: Residuo Cys295 come sito normativo allosterico di PHGDH
5. L'effetto di WA sull'equilibrio Redox nelle cellule HCT-116.
La via di sintesi della serina (SSP) svolge un ruolo fondamentale nel mantenimento dell'equilibrio redox cellulare fornendo precursori per la sintesi del glutatione (GSH) e la produzione di NADPH, essenziali per le reazioni redox. Gli autori hanno studiato l’impatto del WA sull’equilibrio redox nelle cellule HCT-116 e hanno osservato che il WA porta ad un aumento dei livelli di specie reattive dell’ossigeno (ROS), riducendo di conseguenza i rapporti GSH/GSSG e NADPH/NADP+, indicativi di un maggiore stress ossidativo.
L'analisi Western blot ha rivelato un'espressione elevata di γ H2AX, caspasi3 scissa e PARP scissa, insieme a una diminuzione dell'espressione di CHK2 e ciclina D1, suggerendo l'induzione dell'apoptosi da parte di WA. Inoltre, la perdita di PHGDH ha comportato un aumento della produzione di ROS, un'inibizione della proliferazione delle cellule HCT-116 e una ridotta citotossicità di WA nelle cellule con bassa espressione di PHGDH. Questi risultati sottolineano il ruolo del PHGDH nella produzione di ROS e nella citotossicità mediata da WA nelle cellule HCT-116.
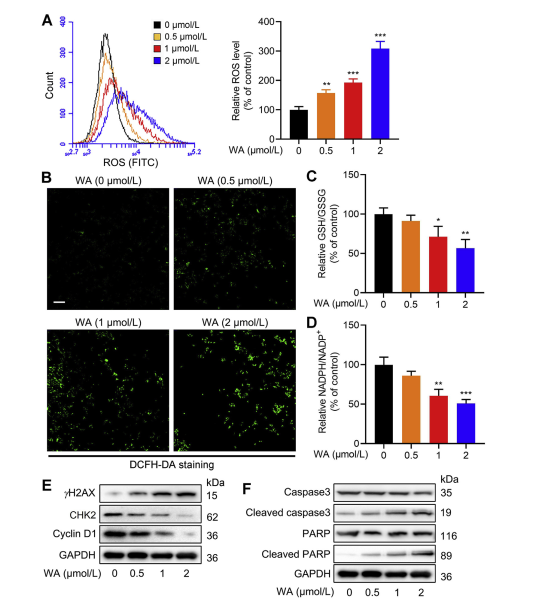
Figura 6: WA aumenta i livelli di ROS intracellulari nelle cellule HCT-116
6. Effetto della proliferazione cellulare nei modelli di xenotrapianto.
Per valutare l'impatto del WA sulla proliferazione delle cellule HCT-116 in vivo, gli autori hanno creato un modello di xenotrapianto utilizzando cellule HCT-116. I risultati hanno rivelato che il WA non ha mostrato effetti significativi sul peso corporeo o sulla morfologia degli organi, indicando una bassa tossicità.
Per studiare ulteriormente la selettività di WA per l'inibizione del PHGDH, gli autori hanno generato un modello di xenotrapianto utilizzando cellule HCT116 knockout (KO) PHGDH. In questo modello, l'assenza di PHGDH ha inibito marcatamente la proliferazione delle cellule HCT-116 (fare riferimento alla Figura 7, AC). Inoltre, l'espressione di Ki67, un marcatore di proliferazione cellulare, è stata significativamente ridotta nel modello di xenotrapianto di cellule PHGDH KO HCT116 (fare riferimento alla Figura 7, D).
In particolare, nel modello di xenotrapianto utilizzando cellule PHGDH KO HCT-116, WA non ha dimostrato alcun effetto inibitorio significativo sulla proliferazione cellulare (fare riferimento alla Figura 7, EG), confermando ulteriormente che l'effetto inibitorio di WA sulle cellule HCT-116 dipendeva da PHGDH.
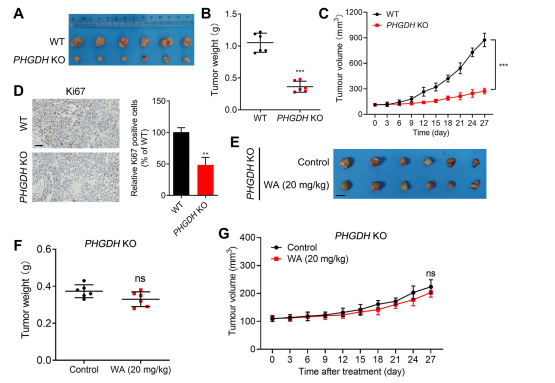
Figura 7: Effetto di WA sulla proliferazione delle cellule PHGDH KO HCT-116 in vivo
I risultati di questo studio non solo forniscono indizi chiave per il futuro sviluppo di farmaci antitumorali per la PHGDH, ma portano anche nuove speranze e potenzialità per lo sviluppo di nuovi farmaci nel campo della terapia del cancro.
Riferimento:https://doi.org/10.1016/j.apsb.2021.06.008

