ABPP 分析により、タンパク質と代謝産物の相互作用を介したイタコン酸の新しい抗炎症メカニズムが明らかに
炎症と免疫調節に不可欠な内因性代謝産物であるイタコン酸は、ChomiX Biotech チームによる共同論文でその役割が解明されています。この研究では、ABPP技術を革新的に使用して、イタコン酸が主要な解糖酵素のシステイン残基のS-グリコシル化を修飾し、それによって細胞代謝に影響を与えることを明らかにしました。研究者らはタンパク質とイタコン酸の相互作用をマッピングし、イタコン酸が解糖経路の複数の酵素に直接結合して調節し、その速度と方向に影響を与えることを発見した。この研究は、疾患に関連した炎症時の代謝制御メカニズムに関する知識を前進させ、小分子がタンパク質の機能をどのように調節するかを探求する際の ABPP の強みを実証します。化学プロテオミクスのリーダーとして、Corollus BioScience は、プローブ設計、サンプル処理、ハイスループット スクリーニング、データ分析を含む包括的なソリューションを提供し、クライアントが同様の代謝調節メカニズムを明らかにするのを支援します。
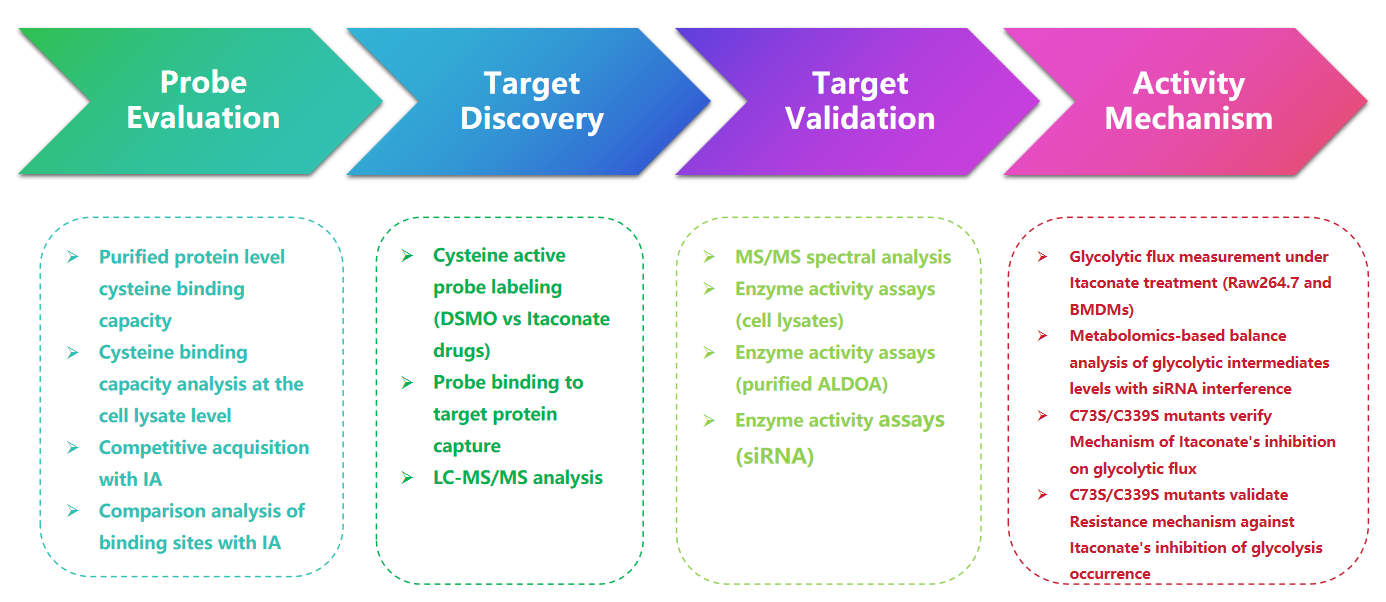
1. 1-OH-Az プローブによるイタコン酸修飾の検出
この研究では、著者らは高度なプロファイリング技術を使用して、イタコン酸を標的としたシステイン残基を調査しました。彼らは最初にゲル電気泳動を通じてプローブ 1-OH-Az を評価し、IA-アルキンを使用して競合実験を実施しました。質量分析による検証により、1-OH-Az がシステイン部位を選択的に標識することが確認され、新たに同定されたタンパク質の 87% は、DrugBank でこれまでリガンド結合タンパク質として記録されていなかったものでした。これらのタンパク質の多様な機能と疾患との関連性を考慮すると、1-OH-Az プローブを使用して、新規治療薬の潜在的な薬物標的として活性システインを同定することができます。
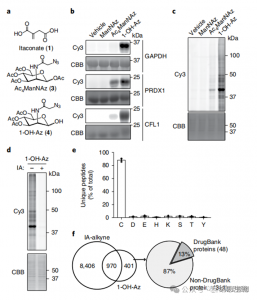
図 1: イタコン酸修飾を検出するための効率的かつ特徴的なシステイン分析プローブとしての 1-OH-Az
2. 定量的プロテオミクス技術を使用したイタコン酸修飾部位の同定
研究者らは、1-OH-Az プローブを使用して、イタコン酸によって修飾されたシステイン残基を定量するために、isoTOP-ABPP 実験を実施しました。ライセートの前処理後、同位体標識リンカー支援定量プロテオミクスを利用して、さまざまな濃度のイタコン酸の影響を分析し、その特定の標的を特定しました。 2 つの濃度の IA-アルキンを使用して比較実験も行われました。この実験では、より幅広い活性と適用範囲が示されましたが、65 個と 50 個の有効な競合部位のみが認識されました。注目すべきことに、1-OH-Az は、同時定量されたシステインの中で著しく高い競争上の優位性を示しました。
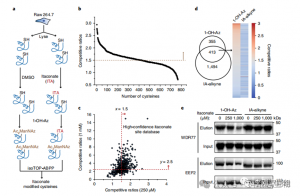
図 2: 1-OH-Az を使用した競合 isoTOP-ABPP を利用したイタコン酸修飾システインの化学プロテオミクス解析
3. イタコン酸は主要な解糖酵素を修飾および阻害します
質量分析により、イタコン酸が 3 つの重要な解糖酵素、ALDOA、GAPDH、LDHA を修飾することが明らかになりました。 ALDOA の Cys73 および Cys339 に対する内因性イタコン酸修飾が、LPS 刺激された Raw264.7 細胞内で確認されました。それらが近接しているため、著者らは、そのような修飾がアルドラーゼ活性に影響を与えるのではないかと推測した。実際、1 mM イタコン酸で処理すると、タンパク質発現に影響を与えることなく、ALDOA 酵素活性が低下しました。さらに、isoTOP-ABPP 分析により、LDHA 上の Cys84 および GAPDH 上の Cys245 もイタコン酸修飾の標的であることが示されました。

図 3: イタコネートは ALDOA 機能を改変し、損なう可能性があります
4. イタコン酸はALDOAを標的とすることで主に解糖を抑制する
炎症性マクロファージ解糖におけるITACの調節的役割を評価するために、著者らは、LPS刺激の前後のRaw264.7細胞におけるグルコース消費と乳酸生成をモニタリングし、ITACが両方を有意に減少させることを実証し、解糖機能の抑制を示した。 ALDOAに対するITACの効果とその後の解糖阻害を検証するために、RNAiを用いて内因性ALDOAをノックダウンし、Raw264.7細胞でWTまたは二重変異体(C73S/C339S)ALDOAを過剰発現させた。予想通り、ALDOA をノックダウンするとグルコース消費と乳酸生成が減少し、細胞が ITAC 処理に対して非感受性になりました。 WT または変異体 ALDOA を再導入すると、未処理細胞の代謝レベルが回復しました。しかし、変異体 ALDOA を過剰発現する細胞は、WT と比較して解糖阻害に対する感受性の低下を示しました。アルドラーゼ活性の酵素アッセイは解糖状態と一致します。
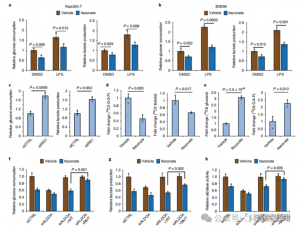
図 4: イタコン酸は ALDOA を修飾することで解糖経路を変化させる
5. ALDOA の阻害は抗炎症反応に寄与する
これらの発見は、ITACがALDOA上のシステイン残基Cys73およびCys339を修飾することによって解糖経路活性を抑制することを明らかにした。著者らはさらに、GAPDHに対するシステイン修飾および解糖阻害を介したフマル酸ジメチルの既知の抗炎症作用から、ITACも同様にフィードバックして解糖を妨害し、抗炎症効果を発揮する可能性があると推論した。 ALDOA をノックダウンすると、LPS 刺激時の IL-1β 分泌が有意に減少し、解糖を介した炎症の調節に ALDOA が関与していることが示唆されました。ピルビン酸の補充によるALDOAノックダウンの抗炎症効果の部分的な逆転は、炎症反応におけるLDHAの役割が限定的であることを示した。
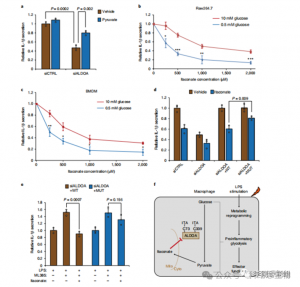
図 5: イタコン酸塩の抗炎症作用は ALDOA の阻害を介して媒介され、結果として解糖系が破壊されます。
要約すると、この論文は、S-グリコシル化ベースのシステインプロファイリング技術とABPP方法論を効果的に利用して、イタコン酸と関連タンパク質の間の相互作用のネットワークを構築しました。これは、イタコン酸がタンパク質上のシステイン残基を特異的に修飾して解糖経路を制御することにより、重要な代謝調節因子として機能することを説得力をもって実証しています。この研究は、新規代謝調節因子としてのイタコン酸の作用機序を解明するだけでなく、小さな代謝産物がどのようにタンパク質と相互作用してコア代謝経路を調節するかについての強力な証拠も提供します。
ABPP に加えて、小分子代謝産物とタンパク質の間の相互作用を研究する他の方法には次のようなものがありますが、これらに限定されません。
1. アフィニティ強化(プルダウン)この技術では、ネイティブ化合物がビオチン化プローブに変換され、細胞溶解物とインキュベートされ、続いてストレプトアビジンを介した濃縮と、ビオチンプローブに結合するタンパク質標的の単離が行われます。
2.限定タンパク質分解質量分析法 (LiP-MS)は、タンパク質の親和性に基づいた標的発見技術です。薬物や小分子などの特定のリガンドが特定のタンパク質に結合すると、立体構造の変化や立体障害が誘発され、結合していないタンパク質と比較して異なる切断部位が生じます。この方法は、質量分析法を使用してこれらの違いを検出することにより、細胞内の薬物とタンパク質の相互作用を特定し、薬物の分子標的を決定することができます。
3.細胞熱シフトアッセイ (CETSA)当初は抗がん剤標的研究を支援するために開発され、無傷細胞における薬物標的結合を研究するために広く使用されている最初のラベルフリー手法の 1 つです。 CETSA は主に、化合物が標的タンパク質に結合すると熱安定性が高まるという原理に基づいています。サンプルを化合物および対応するコントロールとともにさまざまな温度勾配でインキュベートした後、リガンドに結合したタンパク質は加熱後も折りたたまれた状態で比較的安定していますが、結合していないタンパク質は変性により展開して沈殿します。その後、融解曲線に基づいたイムノブロッティングまたは質量分析ベースのアプローチによる可溶性タンパク質の熱安定性の分析により、化合物と細胞内タンパク質の間の相互作用が確認されます。
4. アフィニティークロマトグラフィー標的代謝産物を固相マトリックスに結合させて、それと相互作用するタンパク質複合体を捕捉することが含まれます。捕捉されたタンパク質は、質量分析などの技術を使用して同定されます。
5.表面プラズモン共鳴 (SPR)は、小分子とタンパク質間の相互作用に関連する反応速度パラメーターのリアルタイムのラベルフリー測定に使用されます。
6. タンパク質結晶学低分子リガンドと複合体を形成したタンパク質の三次元構造を解明し、結合部位と作用機序についての直感的な洞察を提供します。これらの構造を解明することで、研究者は小分子がタンパク質標的とどのように相互作用するかを直接視覚化することができます。

