化学プロテオミクスを使用した光線角化症のメブ酸インゲノールの機能標的 SLC25A20 の同定
この研究では、化学プロテオミクスを利用して、太陽角化症の治療に使用される薬剤であるマクロモロールメチルブチレート(Ing-Meb)の新規標的を明らかにしました。研究チームは当初、Ing-Dayneという名前のIng-Meb光親和性プローブを考案、合成しました。これは、UV光にさらされると標的タンパク質と共有結合を形成し、潜在的な機能的標的の同定を容易にします。その後の検証を通じて、著者らはSLC25A20がIng-Mebの極めて重要な標的であることを特定した。 SLC25A20 は、脂肪酸代謝に関与するミトコンドリア膜結合カルニチン - アシルカルニチン トランスロカーゼです。注目すべきことに、SLC25A20機能に対するIng-Mebの阻害作用は長鎖アシルカルニチンの蓄積の増大をもたらし、これはIng-Mebが脂肪酸酸化経路を調節することによって治療効果を引き出すことを実証している。さらに、この研究では、天然物の調査における構造改変の重要性についても掘り下げています。研究者らは、Ing-Mebの構造改変を通じてIng-Dayne光親和性プローブを合成することで、従来の理解とは異なる新たな標的を発掘することに成功した。これは、Ing-Meb とその作用機序の理解を高めるだけでなく、天然物の複雑さを解明するための化学プロテオミクス研究における構造修飾の極めて重要な役割を強調します。このような洞察は、既存の薬効の最適化、特定のエンティティを対象とした新しい治療法の開発、薬の副作用メカニズムの解明など、医薬品のイノベーションをさらに推進します。
研究ルート
実験プロセス
1. 合成 Ing-Dayne 光親和性プローブの設計により、光線角化症治療薬 Ing-Meb の標的タンパク質への結合の基礎となる機構が明らかになります。
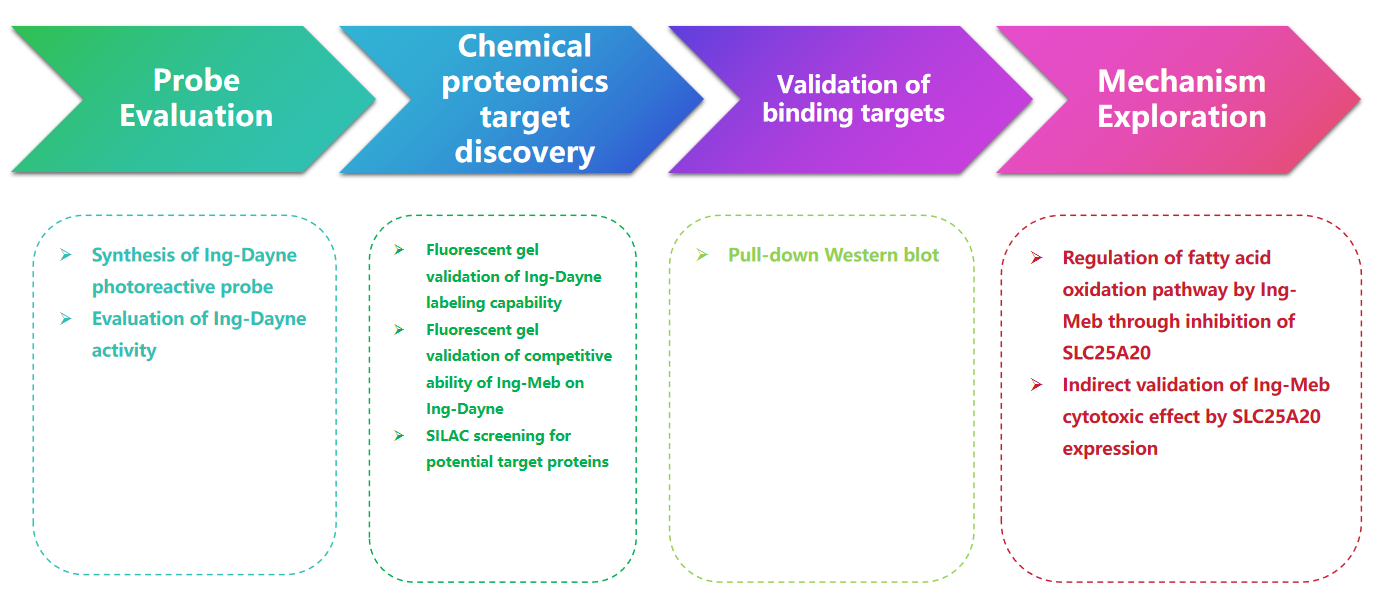
本研究では、光線角化症治療薬Ing-Meb由来のIngアフィニティプローブIng-Dayneを使用しました(図1参照)。このプローブ分子を特定の細胞と共培養し、その後紫外線を照射することにより、プローブ内の二重アクリジン構造が細胞内タンパク質と安定した共有結合を形成しました。細胞溶解時に、クリック化学反応により、レポーター グループ アジド-テトラメチルローダミンの標的タンパク質への結合が促進されます (図 2 を参照)。その後の SDS-PAGE 分析 (図 3 に示す) により、Ing-Meb がプローブに対して顕著な競合結合効果を示したのに対し、同様の構造を有する Ingenol は競合阻害を示さなかったことが明らかになりました。
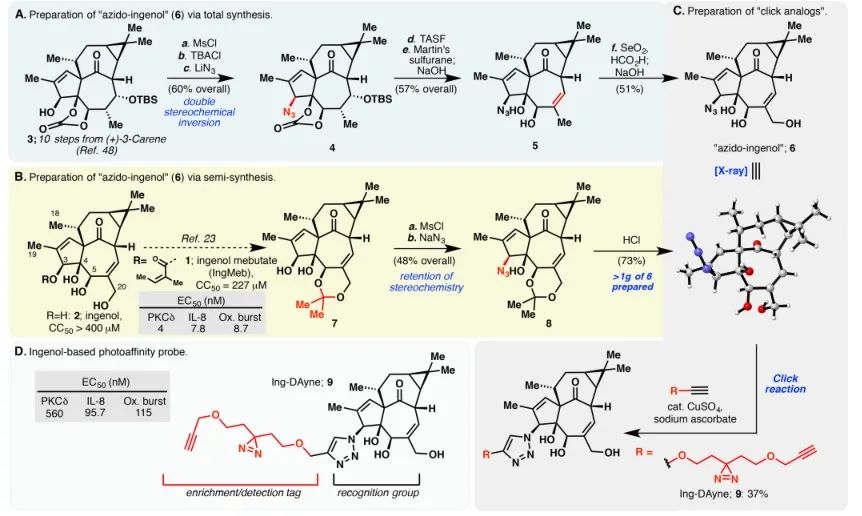
図 1: Ing-Dayne の合成に使用される 2 つの合成経路を示します。
2. 新規プローブ 11b は、THP-1 細胞内の BBR の 44 個の炎症関連標的タンパク質を同定し、EIF2AK2、eEF1A1、PRDX3、および VPS4B が BBR と特異的な相互作用を持つ直接標的であることを明らかにしました。
著者らは、一連の実験を通じて、新規プローブ 11b を使用して、THP-1 細胞内の潜在的な標的タンパク質をタグ付けして精製することに成功しました。これに続いて、彼らはLC-MS/MS分析を利用して、分子量範囲20〜80 kDaの44の炎症関連タンパク質を同定し、そのうち6つがBBRの抗炎症作用において重要な役割を果たす可能性があることが判明した。さらなる研究により、EIF2AK2、eEF1A1、PRDX3、および VPS4B が BBR の直接の標的であることが確認され、高濃度の BBR 処理下で競合阻害効果を示しました。この発見は、これらのタンパク質とBBRの間に特異的な相互作用が存在する可能性が高いことを明らかにし、それによって、抗炎症過程における薬剤との関与についての新たな洞察が解明された。
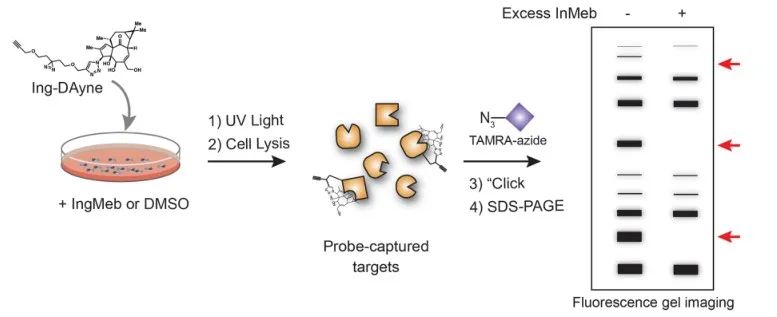
図 2: Ing-Dayne ターゲットのゲルベースの検証プロセス。
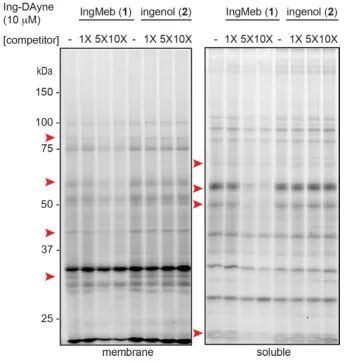
図 3: プローブ分子 Ing-Dayne に対する Ing-Meb とインゲノールの競合阻害。
3. SILAC スクリーニングとウェスタンブロット検証を組み合わせたところ、SLC25A20 が Ingenol クラスの薬剤 Ing-Meb の主要な標的であることが特定されました。
著者らはまず、細胞培養アミノ酸による安定同位体標識 (SILAC) テクノロジーを使用して、28 種類の潜在的な標的タンパク質をスクリーニングしました (図 4)。その後、さらなるスクリーニングおよびウェスタンブロット検証実験(図5)を通じて、研究者らは、Ing-Mebがこれらの候補標的の中でSLC25A20に対して最も強い阻害効果を示すことを観察し、SLC25A20がIng-Mebの中核となる機能標的の1つであることを強く示唆した。
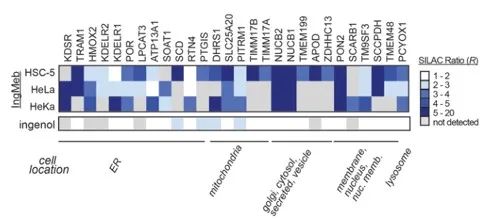
図 4: 最初のスクリーニングによって得られた 28 個の潜在的なターゲット。
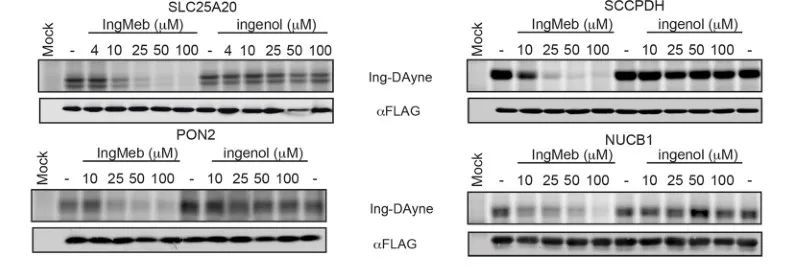
図 5: 4 つの潜在的な標的タンパク質のウェスタンブロット実験。
4. Ing-Meb は、ボツリヌス菌アルカリリポイルトランスフェラーゼとしても知られるミトコンドリア膜タンパク質である SLC25A20 を阻害することで脂肪酸酸化経路を調節し、それによって光線角化症の治療薬としての標的を明らかにします。
著者らは、ボツリヌスアルカリリポイルトランスフェラーゼまたはCACTとしても知られる、ミトコンドリア膜内に局在する多峰性内在性膜タンパク質であるSLC25A20を研究した。その主な機能には、長鎖アシルカルニチンをミトコンドリアに輸送し、遊離カルニチンとの交換を促進することが含まれます。これらの輸送されたアシルカルニチンは、その後、カルニチンパルミトイルトランスフェラーゼ-2 (CPT-2) によって脂肪アシルCoA に変換され、脂肪酸 β 酸化の前駆体として機能します。実験結果では、光線角化症治療薬 Ing-Meb の濃度が増加すると、細胞の長鎖アシルカルニチン含有量が大幅に増加することが明らかになりました (図 6 に示す)。この観察は、SLC25A20に対するIng-Mebの阻害効果を強く支持しており、それによってSLC25A20がIng-Mebの作用を媒介する主要な標的の1つであることが確認される。
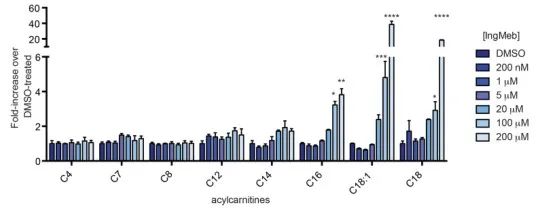
図 6: 長鎖アシルカルニチンに対する Ing-Meb の効果
5. SLC25A20発現を介したIng-Meb細胞毒性効果の間接的検証:薬物活性制御におけるその標的機能を明らかにする。
研究者らは、HeLa 細胞における SLC25A20 の阻害と、Ing-Meb の潜在的な細胞毒性効果を直接結び付けることを目指しました。結果は、SLC25A20の過剰発現はこれらの細胞におけるIng-Mebの阻害濃度の半分を変化させなかったが、SLC25A20発現の増加が長鎖アシルカルニチン蓄積に対するIng-Mebの影響を有意に軽減したことは注目に値することを示した(図7に示す)。 。この結果は、SLC25A20がIng-Mebの薬物活性の極めて重要な機能標的として機能するという仮説をさらに裏付けるものである。
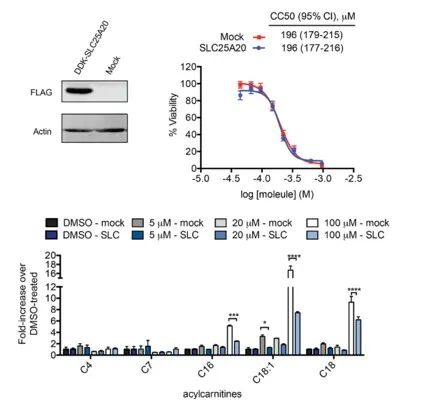
【図7】CC50およびアシルカルニチンに対するSLC25A20の発現の有無の影響。
この研究は、Ing-Meb の新しい標的を明らかにするだけでなく、構造的に複雑な天然産物の標的を発見するための新しい理論的基礎と戦略的方向性も提供します。参照:

