技術的背景
化学プロテオミクス技術は変化の先駆けとして出現し、創薬を精製タンパク質から生細胞の領域へと導きます。
化学プロテオミクス技術は、生細胞内の小分子とタンパク質の相互作用の研究を特徴とする、堅牢な創薬プラットフォームとして機能します。当社の共有結合性創薬プラットフォームの 1 つは、システイン残基のチオール基との共有結合反応を通じてタンパク質標的と結合する共有結合性バインダーを発見するように設計されています。従来の単一標的スクリーニング戦略とは異なり、化学プロテオミクス プラットフォームにより、生細胞内の求電子性フラグメントとほぼすべてのタンパク質の間の相互作用をアミノ酸残基の分解能で定量分析できます。 10,000 以上のタンパク質を網羅していることを誇ります。いくつかの哺乳動物細胞株からの約 40,000 個のシステイン サイト (潜在的な薬物結合部位)。

ワークフロー
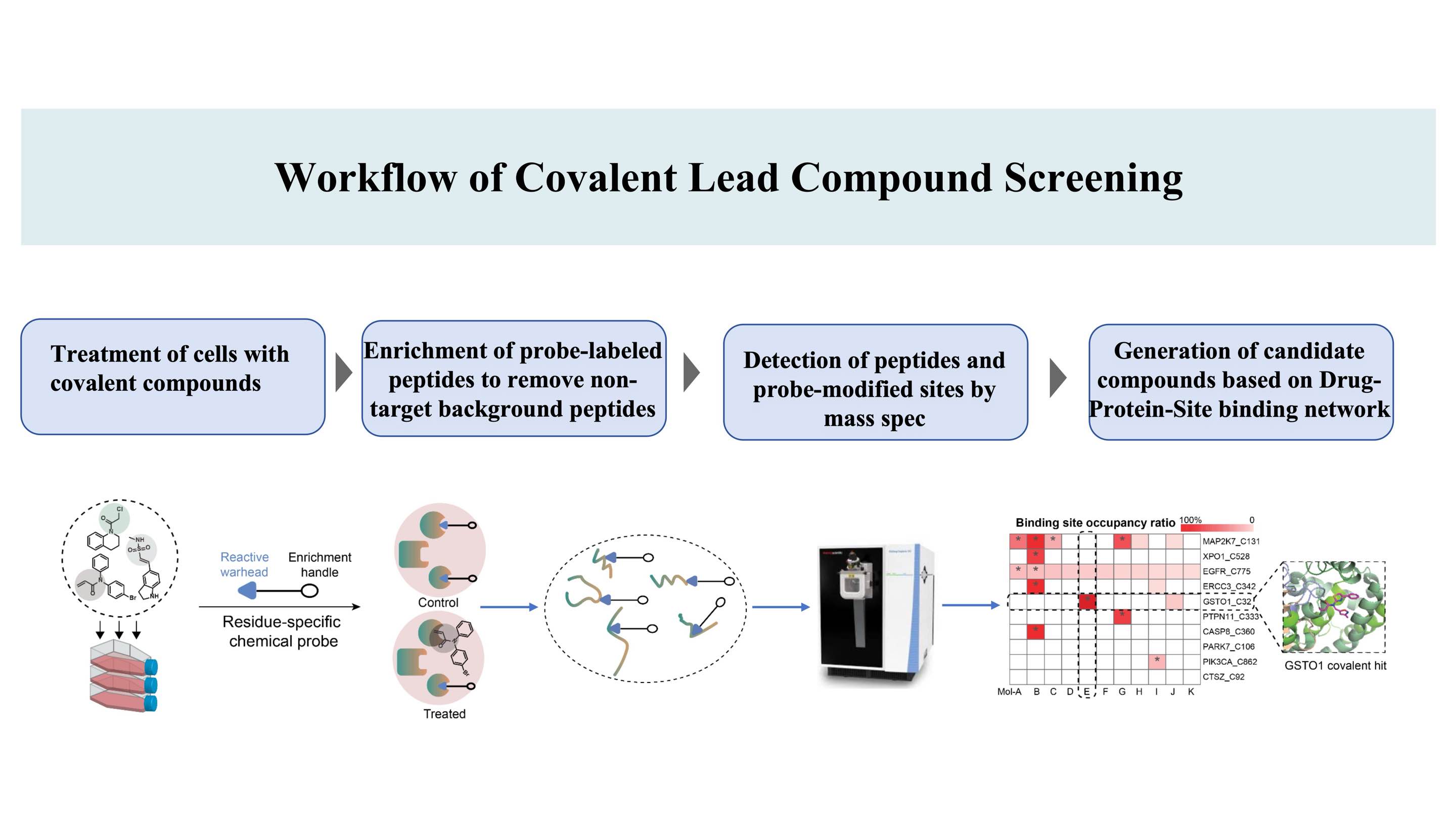
DIA-ABPP (Data-Independent Acquisition-Activity-Based Protein Profiling) 特許に基づく、タンパク質上の結合部位*をターゲットとする共有結合化合物を発見するためのワークフロー (共有結合部位は、化学プローブで標識できるアミノ酸です。それによりリガンド性が可能になります)
技術的な利点
特徴1
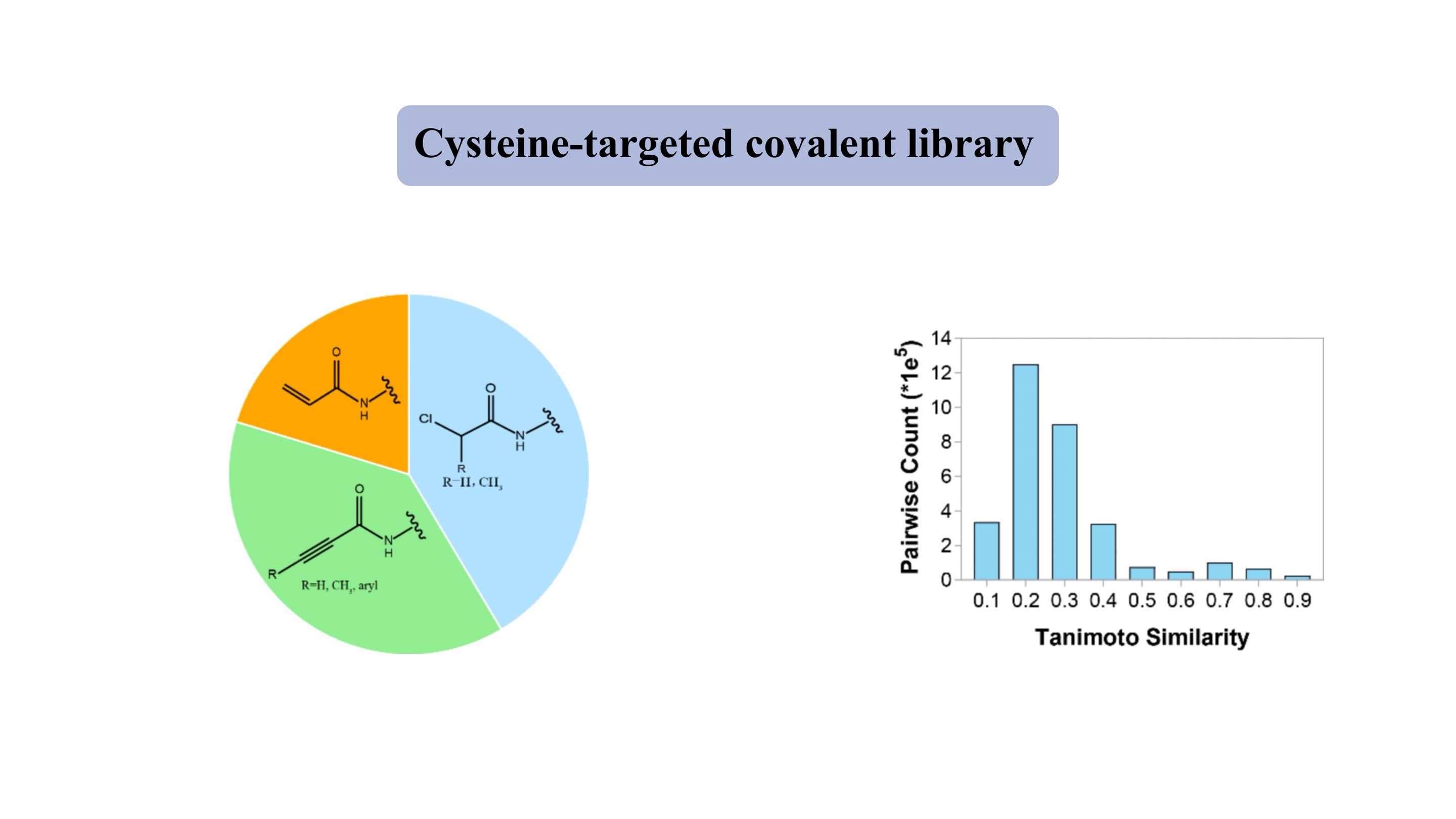
システインを標的とした共有結合ライブラリー
システインをターゲットとした共有結合ライブラリーには、アクリルアミドやクロロアセトアミドなどの代表的な穏やかな求電子性「弾頭」が含まれています。 「薬物のような」ライブラリには約 3000 の化合物が含まれており、80% 以上が 300 ~ 500 Da の分子量を示します。ほとんどの化合物では、Tanimoto 類似性指数は 2 つのメンバーごとに約 0.3 であり、高度な多様性を示しています。
特徴2
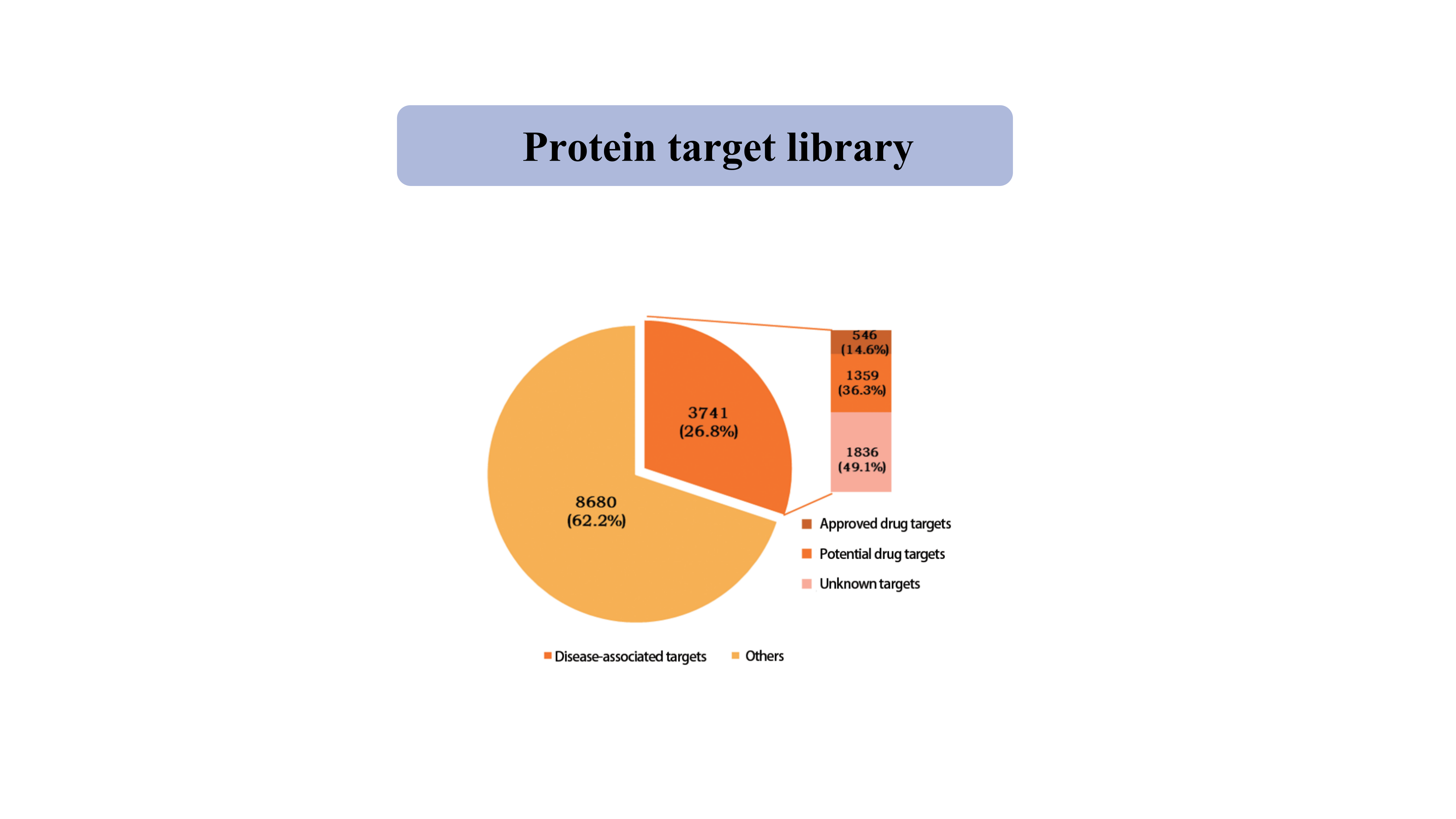
タンパク質ターゲット図書館
現在、チオール特異的化学プローブによって捕捉されたタンパク質標的のライブラリーは、キナーゼ、ホスファターゼ、リガーゼ、転写因子を含む 12,421 個のタンパク質の 39,962 個のシステイン部位をカバーしています。
ケーススタディ
DCAF1 は 2 つの異なる E3 リガーゼ (CRL4DCAF1 および EDVP) の基質受容体として機能し、タンパク質分解において重要な生理学的役割を果たします。 DCAF1 の WDR ドメインを標的とするいくつかの共有結合および非共有結合バインダーは、標的分解用途をサポートするために開発されています (DCAF1 を立体選択的および部位特異的に結合する求電子 PROTAC による標的タンパク質分解。J. Am. Chem. Soc. 2022, 144, 40, 18688) –18699。DCAF1 ベースの PROTAC に対する活性本質的および後天的分解因子耐性を克服する臨床的に検証された標的、Nat.
我々は、Mol-380がDCAF1_C69と共有結合していることを初めて発見し、WDRドメインとは別に、TPDアプリケーションの潜在的な創薬可能部位として強調しました。私たちの調査結果は、転写因子や膜タンパク質など、生細胞内の薬剤不可能な標的に対する新しいリガンドを発見する上での ChomiX 自動化化学プロテオミクス プラットフォームの重要な価値を強調し、薬剤開発や機能探索における潜在的な影響を強調しています。
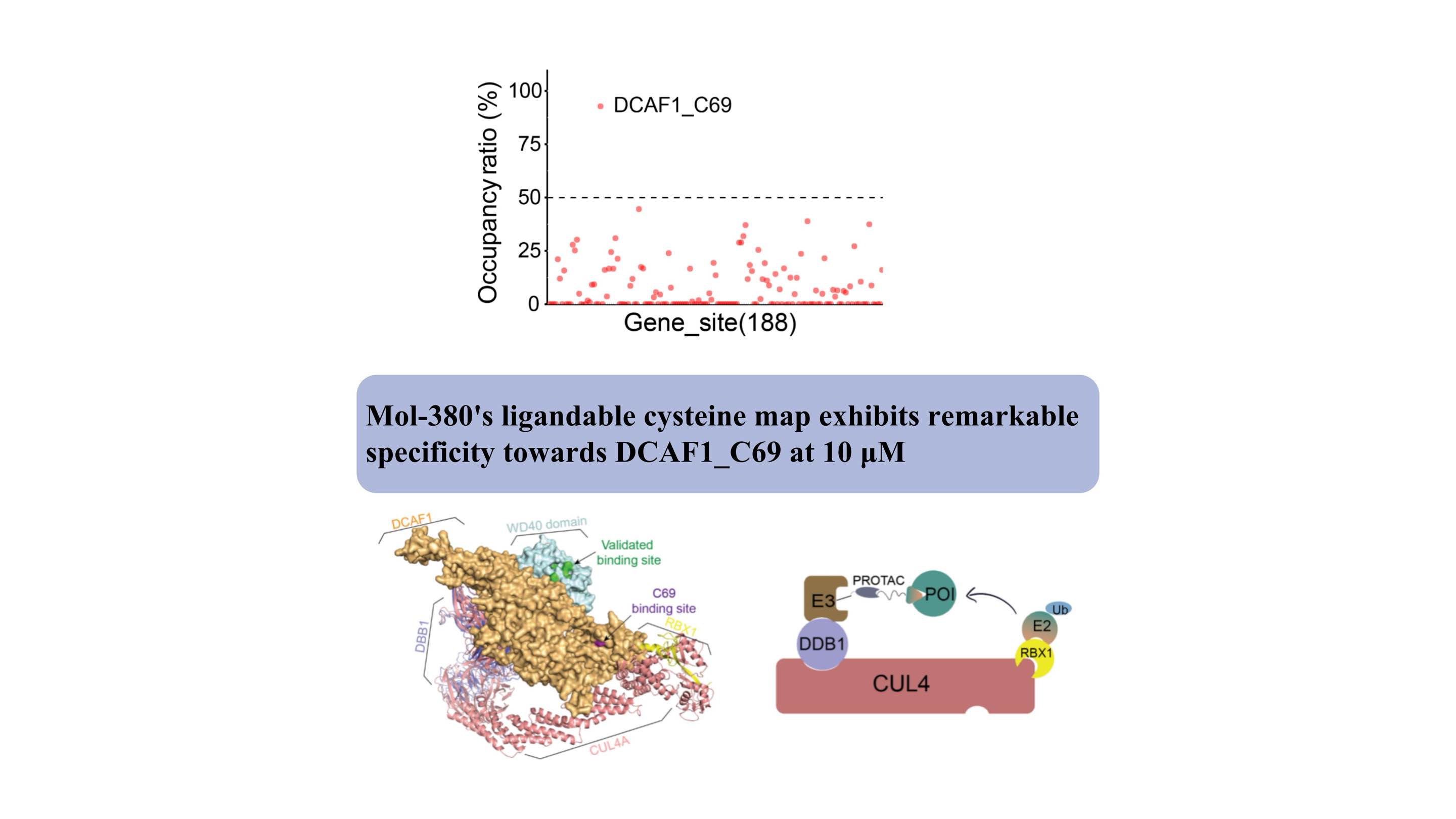
構造的には、複雑なモデルによって示されるように、C69 の結合部位は WD40 ドメイン上の検証済みのポケットに隣接しており、PROTAC 開発のための新規部位を提供します。

