
製品
薬剤不可能な標的に対する新規リード構造の化学プロテオミクス発見
技術的背景
現在、FDA が承認した薬剤の標的となっているタンパク質はわずか約 800 個であり、疾患関連の標的の多くは「創薬不可能」です。なぜなら、現在、ほとんどのテクノロジーは精製されたタンパク質に依存しているからです。ケムプロテオミクスの出現により、精製タンパク質から生細胞まで創薬に革命が起こりました。ヒトプロテオームスケールで低分子とタンパク質間の相互作用を定量的に分析することができます。現在、システイン、リジン、メチオニン、チロシンなどのタンパク質標的の特定のアミノ酸残基に対する共有結合構造の発見が、細胞溶解物および生細胞で実証されています。 ChomiX は独自のケモプロテオミクス プラットフォームを活用して、「創薬不可能な」標的の障壁を迅速に突破します。

技術的な利点
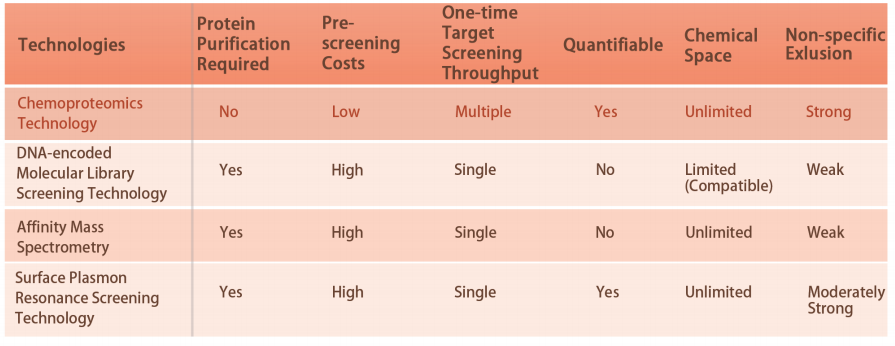
プラットフォームの技術的特徴
DIA-ABPP プラットフォームは、システイン残基のチオール基との共有結合反応を通じてタンパク質標的に結合する共有結合バインダーを発見するように設計されています。タンパク質の活性システイン残基が共有結合分子によって優先的に占有されると、チオール基と特異的に反応するユニバーサルプローブの標識が競合します。 DIA ベースの定量的プロテオミクス技術と組み合わせて、共有結合分子とコントロール グループ間のプローブ標識ペプチドの強度を定量化できます。これらのシグナルの違いは、結合タンパク質に対する共有結合分子の占有率を表します。従来の単一標的スクリーニング戦略とは異なり、DIA-ABPP プラットフォームでは、フラグメント求電子試薬と生細胞内のほぼすべてのタンパク質の間の相互作用をアミノ酸残基の分解能で定量分析できるため、効率が大幅に向上し、ハイスループットのリード構造発見プロジェクトのリスクが軽減されます。 。

共有結合性鉛化合物スクリーニングのワークフロー
特徴1

当社の薬物様分子ライブラリーには、アクリルアミド、クロロアセトアミド、アルキンアミドなどの穏やかな求電子反応性を特徴とするさまざまな反応基 (弾頭) が含まれています。これらの分子は、リピンスキーのルール オブ ファイブに準拠する、構造的に多様なファーマコフォアを特徴としています。
特徴2

現在、チオール特異的化学プローブによって捕捉されたタンパク質標的のライブラリーは、キナーゼ、ホスファターゼ、リガーゼ、転写因子を含む 12,421 個のタンパク質の 39,962 個のシステイン部位をカバーしています。ライブラリは継続的に更新され続けるため、特定のターゲットやサイトに関する最新情報に確実にアクセスできます。特定のターゲットとサイトに関する詳細情報は、以下のリンクからご覧いただけます。
特徴3

このプラットフォームは、1 回のスクリーニング実験で、プロテオーム全体のすべての標識タンパク質に対する小分子 (A2 ~ H6) のターゲット結合を定量化できます。上の図は、選択された臨床的に重要な標的の共有結合分子による部位占有を示しています。色が濃いほど、オルソステリックおよびアロステリック サイトを含む結合ポケットへの分子の占有率が高くなります (アスタリスクは占有率が 80% より高いことを示します)。したがって、各分子の親和性と選択性を同時に評価して、その後の構造を最適化することができます。




