近接標識戦略を通じて明らかになった核酸とタンパク質の相互作用: G4PID プローブと PLGPB 戦略の探索
この記事では、著者らが G4PID と呼ばれる新しい二官能性プローブを紹介する革新的な研究を紹介します。このプローブは、RHAU の G4 結合ドメイン (RHAU23) と miniTurbo ビオチン リガーゼを組み合わせ、G 四重鎖 (G4) の正確なターゲティングと生細胞内の G4 相互作用タンパク質のタグ付けを可能にします。グアニンに富んだ核酸配列によって形成される G4 構造は、遺伝子制御、DNA 複製、修復などのさまざまな細胞プロセスにおいて極めて重要です。 G4 の重要性は広く認識されているにもかかわらず、細胞内の特定のメカニズムやタンパク質との相互作用はほとんど解明されていないままです。著者らは、G4PID を利用して、G4 相互作用タンパク質を正確に同定および分析するための特殊なビオチン標識法 (PLGPB) を開発し、細胞機能における G4 構造の重要な役割を解明しました。このアプローチにより、主に転写制御、mRNA スプライシング、クロマチン リモデリングに関与する、G4 と相互作用する 149 個のタンパク質候補の同定に成功しました。 7 つの候補タンパク質の検証により、DNA G4 に対する親和性は異なるものの、RNA G4 結合を好むことが明らかになりました。スプライシング因子 SF3B4 の詳細な検査により、SF3B4 と G4 構造との相互作用が選択的スプライシング イベントに影響を与えることが実証されました。 G4 構造の安定化は SF3B4 の結合効率を変化させ、特定の遺伝子 (例: INPPL1 および PPP6R2) の選択的スプライシングに影響を与えました。

ベルベリンは、抗炎症、低血糖、心血管保護などの幅広い薬理効果を持つ伝統的なアルカロイドであり、かなりの注目を集めています。しかし、特に炎症抑制におけるその正確な分子機構は依然として不明である。
この研究は、ABPP テクノロジーを使用してこの知識のギャップを埋め、ベルベリンが抗炎症作用に関与する重要な標的として EIF2AK2 を特定しました。この発見は、ベルベリンのメカニズムについての理解を深め、ベルベリンの位置付けを変更し、EIF2AK2 を標的とする新しい抗炎症薬を開発するための科学的根拠を提供します。
研究チームは、高度な化学プロテオミクス手法を利用してベルベリンと細胞内タンパク質の相互作用を体系的に調査し、ベルベリンのEIF2AK2への特異的結合とその酵素活性の調節を確認した。これは炎症反応経路に影響を与え、炎症の進行を効果的に阻害します。この重要な進歩は、ベルベリンの抗炎症メカニズムに関する洞察を提供し、EIF2AK2 を標的とする新規治療法の開発をサポートします。
ChomiX は、ABPP や CETSA などの最先端のサービスを提供して、研究者による薬物メカニズムの探索や新薬開発の取り組みの促進を支援します。
研究ルート

実験プロセス
1. G4PID プローブの構築と特異性の検証。
著者らは最初に、G4結合ドメインRHAU23がN末端に位置し、miniTurboがC末端に位置し、柔軟なリンカーで連結されたG4PIDプローブを設計した。 BL21(DE3)株を用いて発現および精製を行った。精製 G4PID を用いた特異的結合検証実験により、BCL2 G4 への正確な結合が明らかになり、15 ± 7 nM の Kd 値を示し、他の非 G4 構造に対しては無視できる親和性を示しました。さらに、著者らは G4PID のビオチン化特異性を評価し、G4 相互作用タンパク質を選択的にビオチン化する能力を実証しました。
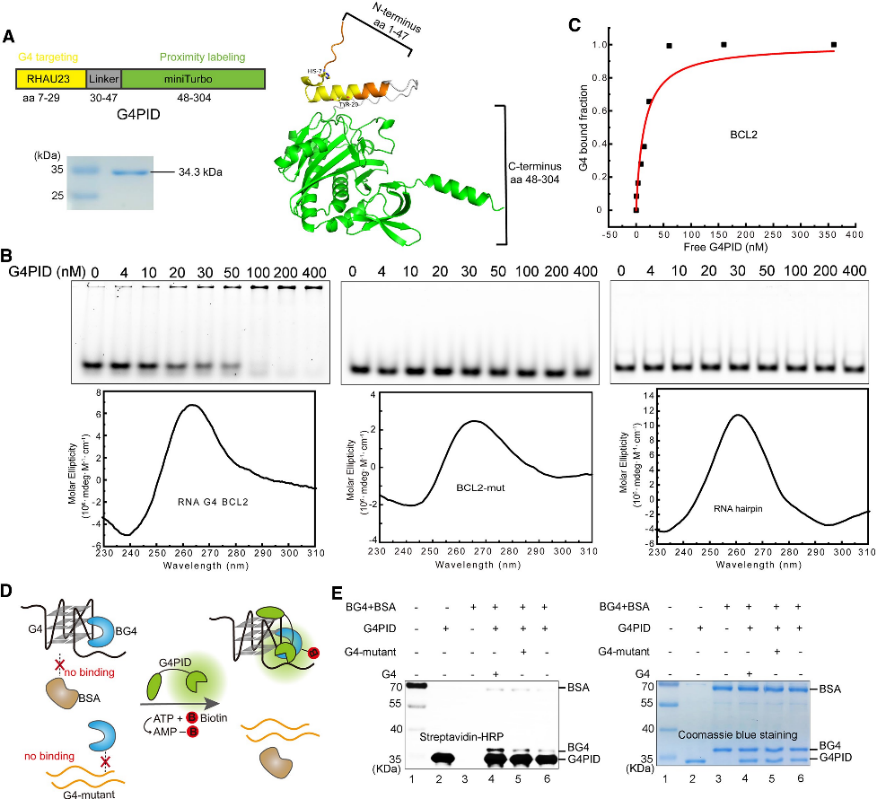
図 1 G4 PID は G4 相互作用タンパク質の特異的なビオチン化を媒介します
2. 細胞における G4PID の RNA G4 結合能力およびビオチン標識特性。
著者らは、eCLIP実験によって細胞内RNA G4に対するG4PIDの結合親和性を調査するために、HA-G4PIDおよびHA-miniTurbo HeLa細胞株を樹立した。結果は、G4PID と RNA G4 の選択的相互作用を実証し、ランダム配列と比較して、PQS を含む RNA 配列に対して顕著に高い結合親和性を示します。さらに、著者らは、補因子を必要とせずに細胞内でのビオチン標識の開始を促進するG4PIDのユニークな特徴を観察しました。これにより、タンパク質標識効率が大幅に向上し、30 分以内に G4PID の明らかなビオチン化シグナルが検出され、miniTurbo と比較して標識速度が速いことが示されました。
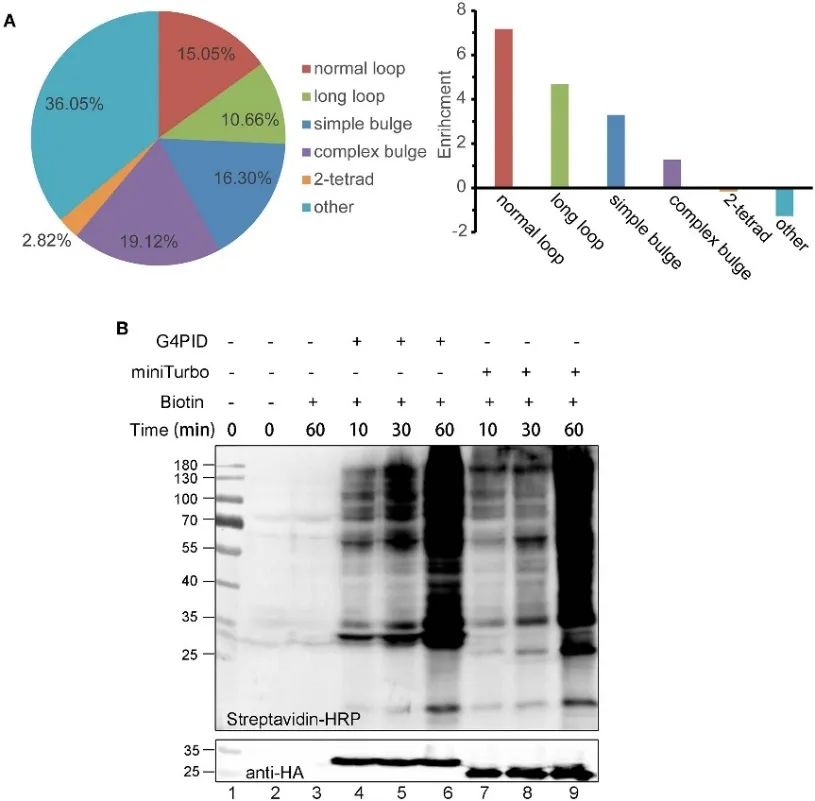
図 2 G4 PID と RNA G4 実験および HEK293T 細胞における標識効率の最適化を組み合わせたもの。
3. PLGPB メソッドを使用した細胞内 G4 相互作用プロテオームの捕捉と検出。
その後、著者らは、G4PID プローブを使用して、G4 相互作用タンパク質の近接標識 (PLGPB) アプローチを使用して、生細胞内の G4 相互作用プロテオームを捕捉および検出しました。 578 個のタンパク質を含む 3 回の独立した反復実験で、80% の同一性を達成し、HEK293T 細胞に G4PID と miniTurbo を用いたトランスフェクションを実施しました。スクリーニングにより、G4 と相互作用する 149 個の候補タンパク質が明らかになり、G4 相互作用タンパク質の既存のデータベースとの顕著な重複が示されました。さらに、ジーンオントロジー(GO)濃縮分析により、これらのタンパク質と転写制御、mRNAスプライシング、およびクロマチンリモデリングとの実質的な関連が示され、これはG4研究における以前の発見と一致しています。
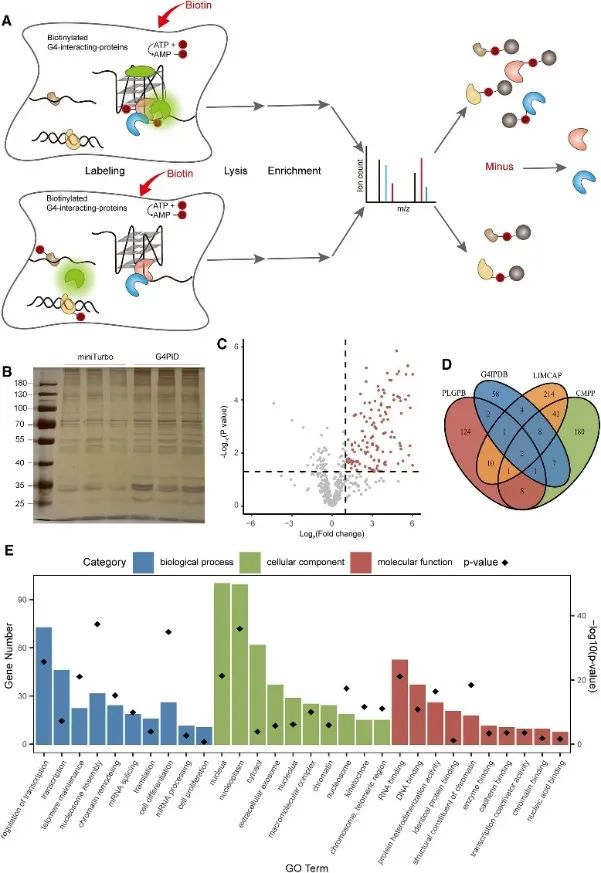
図 3 は、PLGPB 法により G4 と相互作用するタンパク質を同定しました。
4. 新たに同定された候補における G4 結合親和性の検証。
著者らはPLGPB法を通じて、一般的なテロメア関連タンパク質、転写因子、比較的珍しいタンパク質結合タンパク質など、さまざまな機能カテゴリーを含む一連の候補を発見した。これは、PLGPB メソッドが、これまでに認識されていた G4 相互作用タンパク質を再確認するだけでなく、多様な機能クラスにわたる新規候補を明らかにすることでタンパク質の展望を大幅に広げることを示しています。さらに、著者らはこれらの候補のRNA G4およびDNA G4に対する結合能力を検証し、RNA G4に対する顕著な優先性と、異なる立体構造におけるDNA G4に対する親和性の変化を明らかにした。これらの発見は、G4 立体構造を制御することによってタンパク質と G4 の相互作用を調節する可能性を強調しています。
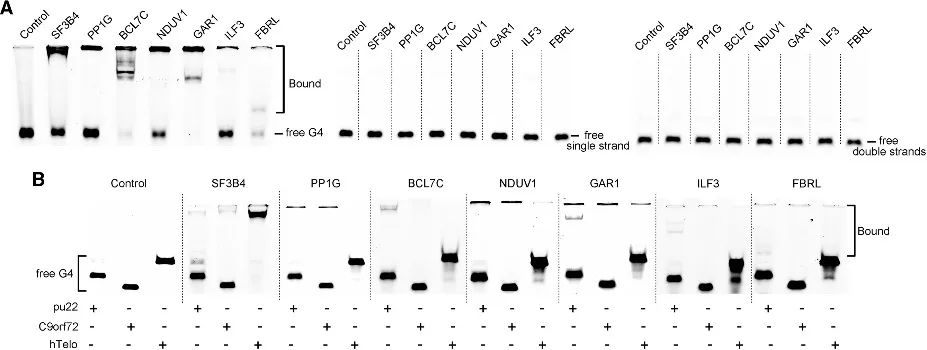
図 4 候補タンパク質と RNA G4 および DNA G4 との相互作用。
5. SF3B4 および G4 構造の信頼性の高い結合部位の決定。
G4 結合の in vivo モードの研究中に、著者らは SF3B4 タンパク質の重要な役割を発見しました。 RNA スプライシングに関与することで知られる SF3B4 は、eCLIP 実験と rG4-seq および DMS-seq データの包括的な分析を通じて、その信頼性の高い結合部位が同定されました。これらの結合部位の約半分には PQS が含まれており、主に型破りな G4 構造と結合していました。さらに、著者らは、SF3B4 結合部位と RNA PQS の間に密接な空間的関係があり、主にイントロン領域内、特に 3' スプライス部位の近位に集中して分布していることを観察しました。これらの発見は、SF3B4 と G4 構造間の相互作用が選択的スプライシング機構において重要な役割を果たしている可能性を強く示唆しています。
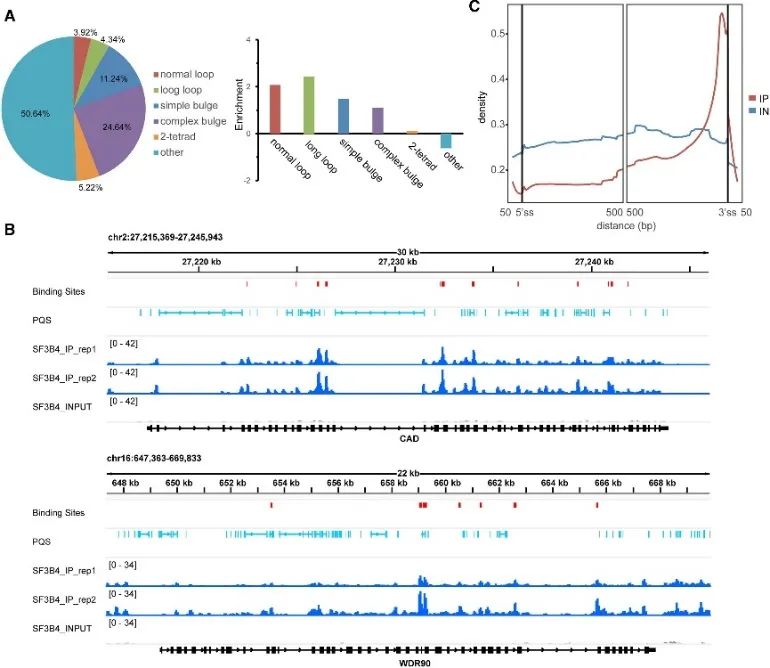
図 5 は、eCLIP テクノロジーを使用した細胞における SF3B4 の G4 結合優先度を示しています。
6. G4 構造は SF3B4 媒介選択的スプライシングを制御します。
著者らは、SF3B4結合部位の分析を行ってG4構造との関連を明らかにし、選択的スプライシング事象におけるその調節機構をさらに調査した。選択的スプライシングに関係する従来の PQS をスクリーニングし、INPPL1 と PPP6R2 の 2 つの遺伝子を選択して詳細な検査を行いました。 INPPL1 および PPP6R2 内の G4 構造 (G4-INPPL1 および G4-PPP6R2 と呼ばれます) が確認され、SF3B4 がこれらの G4 構造に特異的に結合することが確認されました。さらに、G4 リガンドであるピリドスタチン (PDS) の添加により、SF3B4 の G4 構造への結合が減少し、その結果、INPPL1 および PPP6R2 mRNA スプライシング中のエクソン封入イベントが促進されることが実証されました。これらの発見は、SF3B4 媒介選択的スプライシングにおける G4 構造の潜在的な重要性を示しています。
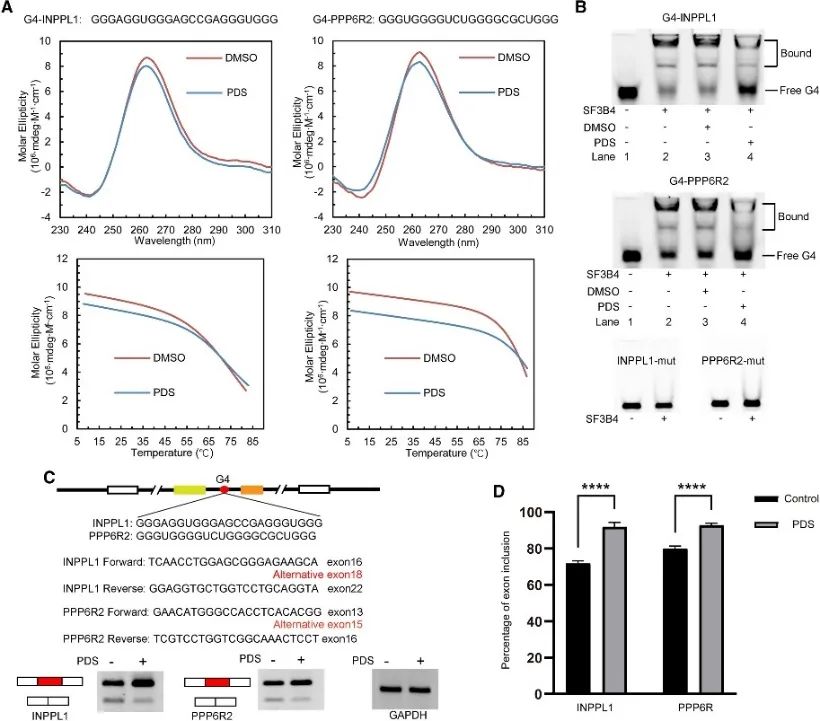
図 6 SF3B4 は G4 構造に結合し、mRNA の選択的スプライシングに影響を与えます。
結論として、この研究は、G4PID プローブと PLGPB 戦略を含む効率的なツールキットを導入し、細胞内の G4 とタンパク質の間の相互作用が遺伝子発現にどのように影響し、特に選択的スプライシングの極めて重要なプロセスに影響を与えるかを解明します。これらの発見は、細胞の生物学的プロセスにおける G4 に関与する調節機構の理解を深め、G4 関連疾患の治療戦略のさらなる探索への道を開きます。

