低分子 WA の謎を解明: PHGDH 酵素制御に光を当て、新しい抗がん療法への道を開く
セリンは必須アミノ酸であり、生体内でさまざまな重要な生物学的機能を果たします。それはタンパク質合成の基本的な構成要素として機能するだけでなく、ヌクレオチド合成、メチオニン代謝、抗酸化機能などの多くの代謝経路の調節にも関与しています。これらの経路の中でも、ホスホピルビン酸デヒドロゲナーゼ (PHGDH) は、セリン合成経路の最初のステップを触媒し、3-ホスホグリセリン酸を 3-ホスホヒドロキシピルビン酸に変換するため、極めて重要な意味を持っています。セリン代謝における中心的な役割を考えると、PHGDH 機能の異常は、多くの病気、特に癌の発症と進行に複雑に関連しています。
この記事では、化学プロテオミクスおよび表現型分析技術を利用して、PHGDH を共有結合的に阻害できる化合物を同定する革新的なアプローチを紹介します。ほとんどの PHGDH 阻害剤は通常、本質的に競合的ですが、著者らは、PHGDH の新規共有結合阻害剤として、天然の小分子であるウィサングラチン A (WA) を紹介しています。 WA は、PHGDH 阻害剤開発の有望なリード化合物として浮上しています。さらに、WA は、PHGDH およびセリン合成経路 (SSP) の機能を調査するための貴重なプローブとして機能します。この阻害剤を活用することで、研究者はセリン代謝を支配する制御機構についてより深い洞察を得ることができ、それによって関連疾患、特に癌の潜在的な治療法を探索する道が開かれます。
この発見は、新しい薬物治療戦略の開発に有望な方向性を提供するだけでなく、疾患の進行におけるセリン代謝の役割についての重要な洞察も提供します。
研究ルート
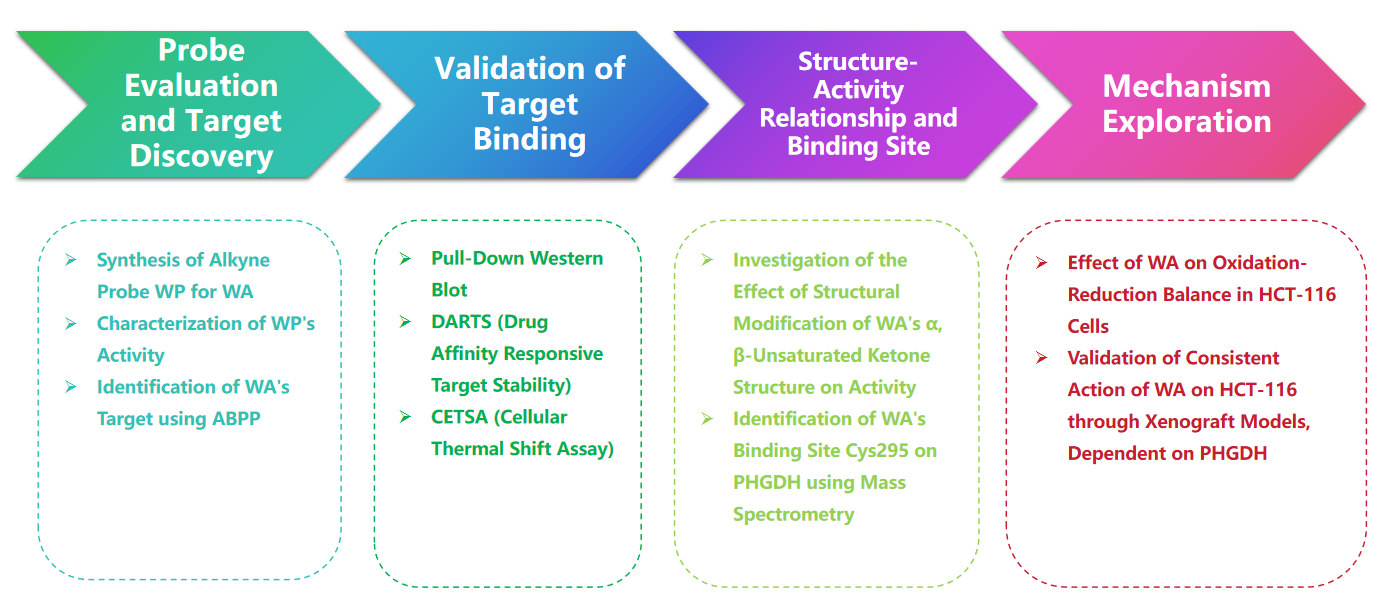
実験プロセス
1. 細胞毒性実験における WP と WA の比較。
この研究において、著者は WP と呼ばれる複合プローブを考案し、合成しました。著者らは、ヒト結腸癌細胞 (HCT-116) と正常結腸細胞 (NCM460) を使用して、WP が WA に匹敵する細胞毒性を示すことを観察しました。これは、アルキンマーカーを含めてもその細胞毒性効果が大きく変化しないことを示唆しています。さらに著者らは、WAは正常結腸細胞では細胞毒性が低いが、結腸がん細胞ではより高い細胞毒性を示すことを指摘し、結腸がん細胞に対するWAの選択性が強化されたことを強調した。
続いて、著者らは、HCT-116 細胞の WP プローブを利用した、Activity-Based Protein Profiling (ABPP) 戦略を採用しました。このアプローチにより、WA の直接の標的タンパク質として PHGDH が同定されました。 WB プルダウン アッセイを使用して実験的検証が行われ、結果が確認されました。
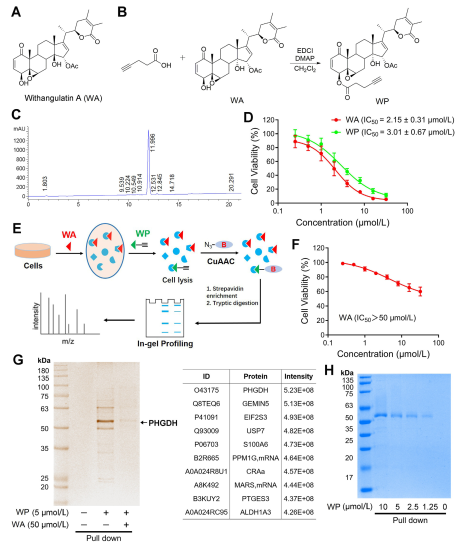
図 1: ウィサングラチン A の標的を特定するための化学プロテオミクス アプローチ。
2. WAとPHGDHの間の直接的な相互作用の確認。
著者らは、活性ベースのタンパク質プロファイリング(ABPP)技術を利用して、HCT-116細胞における化合物WAの直接の標的としてPHGDHを特定した。 WAとPHGDHの間の相互作用を検証するために、著者らは薬物親和性反応性標的安定性(DARTS)および細胞熱シフトアッセイ(CETSA)実験を実施した。結果は、WA が PHGDH の熱安定性を高め、その活性を有意に阻害することを実証しました。さらに、生物層干渉法 (BLI) 実験により、WA と PHGDH の間の直接相互作用がさらに確認されました。
著者らは、PHGDH への WA 結合の不可逆的な性質も調査しました。彼らの実験により、PHGDH が WP 結合を妨げることが明らかになりました。ただし、N-アセチルシステイン (NAC) またはグルタチオン (GSH) を含む溶液とプレインキュベーションすると、PHGDH への WP の結合が逆転する可能性があります。これらの発見は、PHGDH タンパク質の WA とシステイン残基間の不可逆的な共有結合を示唆しています。
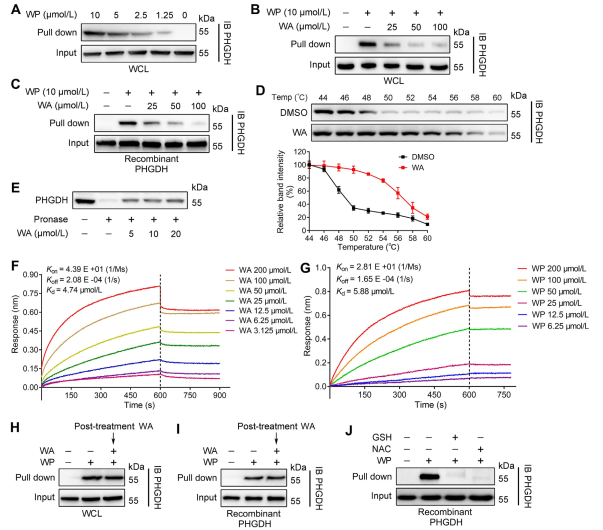
図 2: WA は PHGDH に直接結合します。
3. WAは、α - β -不飽和ケトン部分を介してPHGDHに共有結合します。
WAがPHGDHと相互作用する機構をさらに解明するために、研究者らは、WAのα-β-不飽和ケトン構造を介したPHGDHへの共有結合を確認する実験を行った。最初に、WA の α,β-不飽和ケトン フラグメントが還元されて WA-1 が生成されました (図 3A を参照)。 Cell Counting Kit-8 (CCK-8) アッセイおよびプルダウンタンパク質相互作用アッセイを使用したその後の分析 (図 3B を参照) により、WA の細胞毒性効果が実際にその α および β 不飽和ケトン構造に依存していることが実証されました。逆に、WA-1 は PHGDH の WP への結合を効果的に防ぐことができず (図 3C および D を参照)、それによって PHGDH へのβ-不飽和ケトンの共有結合がさらに確認されました (図 3E を参照)。
腫瘍細胞におけるセリン合成経路 (SSP) プロセスの遮断における PHGDH 阻害または不在の重要な役割を考慮して、著者らは、U-13C グルコース安定同位体標識を使用して、HCT-116 細胞における SSP 活性に対する WA の影響の調査を進めました。図3Jへ)。実験結果により、WA が HCT-116 細胞における SSP 活性を効果的に阻害することが明らかになりました。
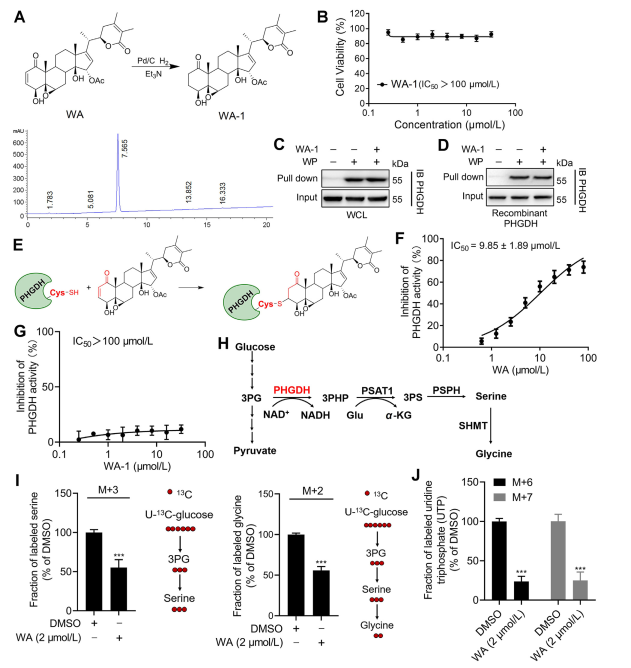
図 3: WA は PHGDH に共有結合し、PHGDH 活性を阻害します。
4. PHGDH の Cys295 残基は WA に共有結合しています。
理論的には、WAのαおよびβ-不飽和ケトン部分は、タンパク質のシステイン残基と共有結合を形成する可能性があります。実際、著者らは、WAによるPHGDHのCys295残基の共有結合修飾を観察した。続いて、彼らはWAがPHGDHのCys295残基に共有結合しているというさらなる証拠を提供し、Cys295の変異がPHGDHに対するWAの阻害活性を有意に低下させることを実証した。さらに、生物層干渉法 (BLI) 実験では、WA と組換え Cys295A PHGDH タンパク質の間に相互作用がないことが明らかになり、WA と PHGDH の選択的共有結合が確認されました。
さらに、分子動力学シミュレーションにより、WA が PHGDH のアロステリック調節因子として機能し、Cys295 残基が PHGDH の新規アロステリック部位として機能する可能性があることが示されました。
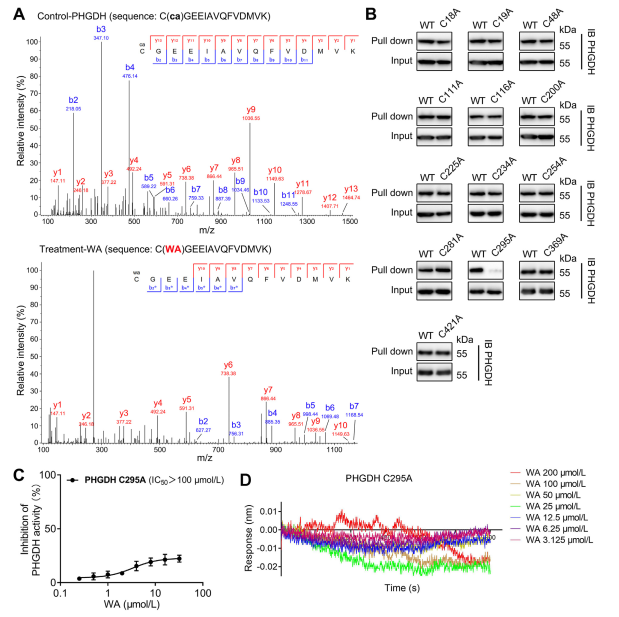
図 4. WA は、PHGDH の Cys295 残基に選択的に共有結合します。
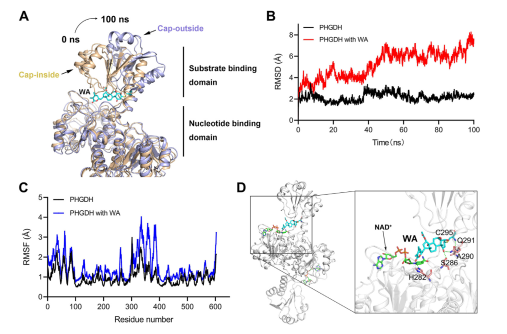
図 5: PHGDH のアロステリック調節部位としての Cys295 残基
5. HCT-116 細胞の酸化還元バランスに対する WA の影響。
セリン合成経路 (SSP) は、酸化還元反応に不可欠なグルタチオン (GSH) 合成および NADPH 生成の前駆体を提供することにより、細胞の酸化還元バランスを維持する上で極めて重要な役割を果たします。著者らは、HCT-116細胞の酸化還元バランスに対するWAの影響を調査し、WAが活性酸素種(ROS)レベルの増加をもたらし、その結果、酸化ストレスの高まりを示すGSH/GSSG比およびNADPH/NADP+比を低下させることを観察した。
ウェスタンブロット分析により、CHK2 およびサイクリン D1 発現の減少とともに、γ H2AX、切断型カスパーゼ 3、および切断型 PARP の発現上昇が明らかになり、WA によるアポトーシスの誘導が示唆されました。さらに、PHGDH の喪失により、PHGDH 発現が低い細胞では ROS 産生が増加し、HCT-116 細胞の増殖が阻害され、WA の細胞毒性が減少しました。これらの発見は、HCT-116 細胞における ROS 産生および WA 媒介細胞毒性における PHGDH の役割を強調しています。
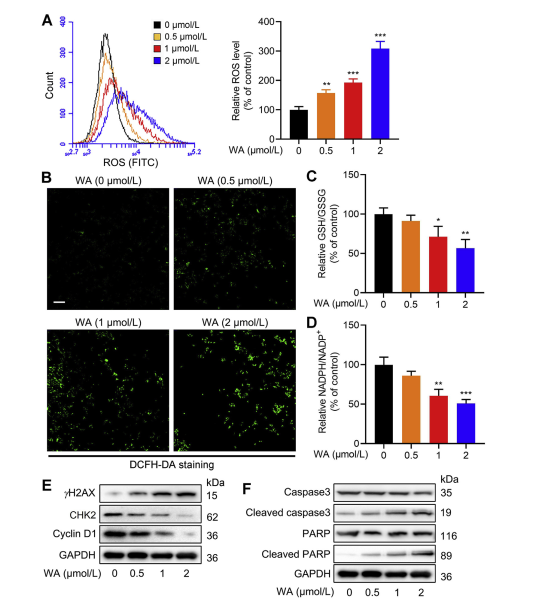
図 6: WA は HCT-116 細胞の細胞内 ROS レベルを増加させます
6. 異種移植モデルにおける細胞増殖効果。
インビボでの HCT-116 細胞の増殖に対する WA の影響を評価するために、著者らは HCT-116 細胞を使用して異種移植モデルを確立しました。その結果、WA は体重や臓器の形態に有意な影響を示さず、毒性が低いことが明らかになりました。
PHGDH 阻害に対する WA の選択性をさらに調査するために、著者らは PHGDH ノックアウト (KO) HCT116 細胞を使用して異種移植モデルを作成しました。このモデルでは、PHGDH の不在により HCT-116 細胞の増殖が著しく阻害されました (図 7、A~C を参照)。さらに、細胞増殖のマーカーである Ki67 の発現は、PHGDH KO HCT116 細胞異種移植モデルにおいて大幅に減少しました (図 7、D を参照)。
注目すべきことに、PHGDH KO HCT-116細胞を用いた異種移植モデルでは、WAは細胞増殖に対する有意な阻害効果を示さず(図7、EGを参照)、HCT-116細胞に対するWAの阻害効果がPHGDHに依存していることがさらに確認された。
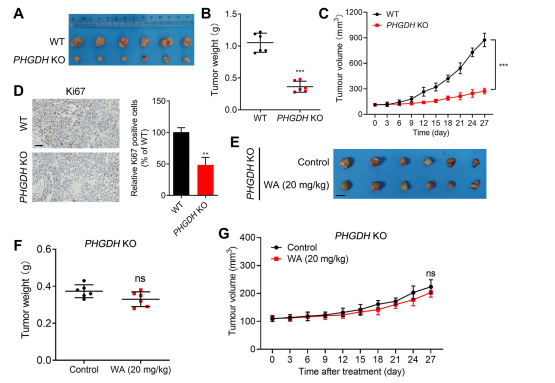
図 7: インビボでの PHGDH KO HCT-116 細胞の増殖に対する WA の効果
この研究結果は、PHGDHに対する将来の抗がん剤開発に重要な手がかりを提供するだけでなく、がん治療分野における新薬開発に新たな希望と可能性をもたらすものである。

