화학적 단백질체학을 사용하여 광선 각화증에 대한 Ingenol Mebutate의 기능적 표적 SLC25A20 식별
이 연구는 일광 각화증 치료에 사용되는 약물인 마크로모롤 메틸 부틸레이트(Ing-Meb)의 새로운 표적을 밝히기 위해 화학적 단백질체학을 활용합니다. 연구팀은 처음에 Ing-Dayne이라는 Ing-Meb 광친화성 프로브를 고안하고 합성했습니다. 이 프로브는 자외선 노출 시 표적 단백질과 공유 결합을 형성하여 잠재적인 기능 표적 식별을 용이하게 합니다. 후속 검증을 통해 저자는 SLC25A20을 Ing-Meb의 중추적 표적으로 식별했습니다. SLC25A20은 지방산 대사에 관여하는 미토콘드리아 막 결합 카르니틴-아실카르니틴 트랜스로카제입니다. 특히 SLC25A20 기능에 대한 Ing-Meb의 억제 작용은 장쇄 아실카르니틴의 축적을 증가시켜 Ing-Meb가 지방산 산화 경로를 조절함으로써 치료 효과를 이끌어낸다는 것을 입증합니다. 또한, 이 연구는 천연물 조사에서 구조적 변형의 중요성을 탐구합니다. 연구진은 Ing-Meb의 구조적 변형을 통해 Ing-Dayne 광친화성 프로브를 합성함으로써 기존의 이해와는 다른 새로운 표적을 성공적으로 발굴했습니다. 이는 Ing-Meb과 그 작용 방식에 대한 이해를 향상시킬 뿐만 아니라 천연물의 복잡성을 풀기 위한 화학 단백질체학 연구에서 구조적 변형의 중추적인 역할을 강조합니다. 이러한 통찰력은 기존 약물 효능의 최적화, 특정 개체를 대상으로 하는 새로운 치료법 개발, 약물 부작용 메커니즘의 해명을 포함하여 약물 혁신을 더욱 촉진합니다.
연구 경로
실험 과정
1. 합성 Ing-Dayne 광친화성 프로브를 설계하면 광선각화증 약물인 Ing-Meb가 표적 단백질에 결합하는 기본 메커니즘이 밝혀집니다.
본 연구에서는 광선각화증 치료제 Ing-Meb에서 파생된 Ing-affinity 프로브 Ing-Dayne을 사용했습니다(그림 1 참조). 이 프로브 분자를 특정 세포와 공동 배양하고 후속 UV 광 조사를 통해 프로브 내의 이중 아크리딘 구조는 세포내 단백질과 안정적인 공유 결합을 형성했습니다. 세포 용해 시 Click 화학 반응은 리포터 그룹 아지드-테트라메틸로다민을 표적 단백질에 부착하는 것을 촉진했습니다(그림 2 참조). 후속 SDS-PAGE 분석(그림 3에 표시)에서는 Ing-Meb이 프로브에 대해 상당한 경쟁적 결합 효과를 나타내는 반면, 유사한 구조를 갖는 Ingenol은 경쟁적 억제를 나타내지 않는 것으로 나타났습니다.
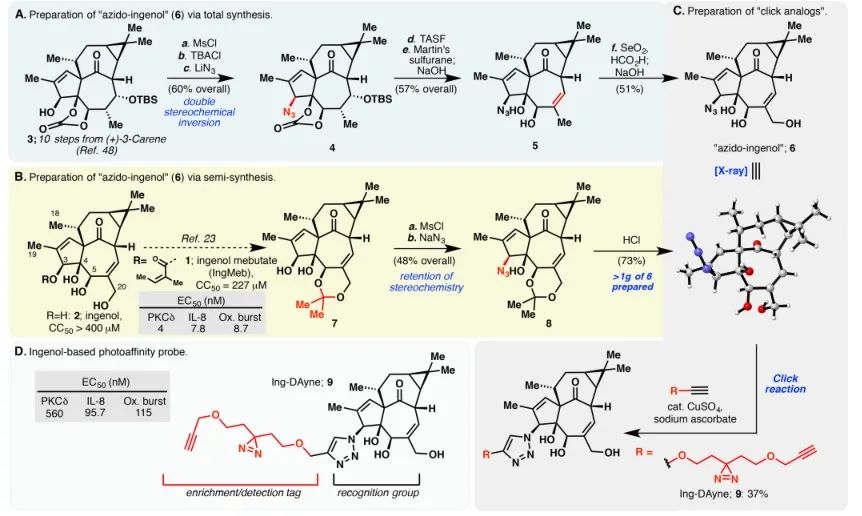
그림 1: Ing-Dayne 합성에 사용되는 두 가지 합성 경로를 보여줍니다.
2. 새로운 프로브 11b는 THP-1 세포 내 BBR의 44개 염증 관련 표적 단백질을 확인했으며, EIF2AK2, eEF1A1, PRDX3 및 VPS4B가 BBR과 특정 상호 작용을 하는 직접적인 표적으로 밝혀졌습니다.
저자들은 일련의 실험을 통해 새로운 프로브 11b를 성공적으로 사용하여 THP-1 세포 내의 잠재적인 표적 단백질을 태그하고 정제했습니다. 그 후, 그들은 LC-MS/MS 분석을 활용하여 20~80kDa의 분자량 범위에서 44개의 염증 관련 단백질을 식별했으며, 그 중 6개는 BBR의 항염증 작용에 잠재적으로 중요한 역할을 하는 것으로 밝혀졌습니다. 추가 조사에서 EIF2AK2, eEF1A1, PRDX3 및 VPS4B가 BBR의 직접 표적으로 확인되었으며 고농도의 BBR 처리에서 경쟁적 억제 효과를 나타냈습니다. 이 발견은 이들 단백질과 BBR 사이에 특정한 상호작용이 존재할 가능성이 있음을 밝혀줌으로써 항염증 과정 동안 약물과의 결합에 대한 새로운 통찰력을 명료하게 해주었습니다.
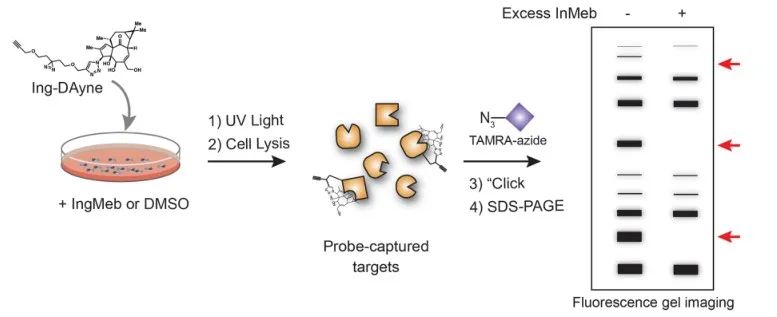
그림 2: Ing-Dayne 표적의 젤 기반 검증 프로세스.
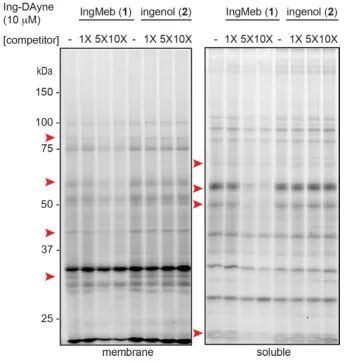
그림 3: 프로브 분자 Ing-Dayne에 대한 Ing-Meb 및 ingenol의 경쟁적 억제.
3. 웨스턴 블롯 검증과 결합된 SILAC 스크리닝을 통해 SLC25A20이 Ingenol 계열 약물 Ing-Meb의 주요 표적으로 확인되었습니다.
저자는 처음에 세포 배양에서 아미노산에 의한 안정 동위원소 표지화(SILAC) 기술을 사용하여 28개의 잠재적인 표적 단백질을 스크리닝했습니다(그림 4). 이후 추가 스크리닝과 웨스턴 블롯 검증 실험(그림 5)을 통해 연구진은 Ing-Meb이 이러한 후보 표적 중에서 SLC25A20에 대해 가장 강력한 억제 효과를 나타냄을 관찰했으며, 이는 SLC25A20이 Ing-Meb의 핵심 기능 표적 중 하나임을 강력히 시사합니다.
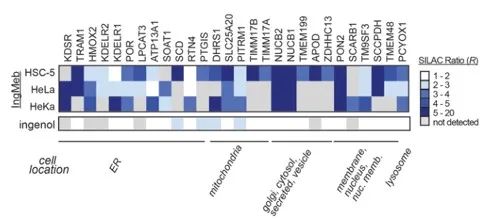
그림 4: 초기 스크리닝을 통해 얻은 28개의 잠재적 목표.
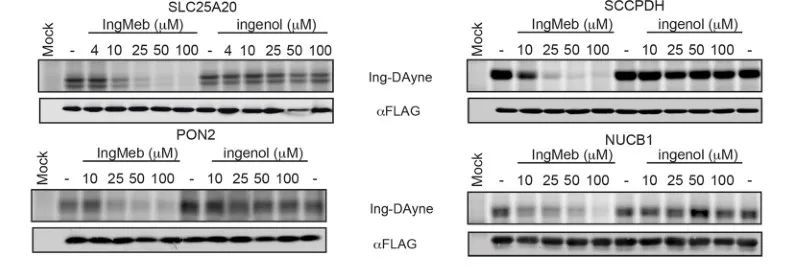
그림 5: 4가지 잠재적 표적 단백질의 웨스턴 블롯 실험.
4. Ing-Meb은 보툴리눔 알칼리지방전이효소라고도 알려진 미토콘드리아 막 단백질인 SLC25A20을 억제하여 지방산 산화 경로를 조절함으로써 광선각화증 약물로서의 표적을 드러냈습니다.
저자들은 미토콘드리아 막 내에 위치하는 다중 모드 통합 막 단백질인 보툴리눔 알칼리 리포일트랜스퍼라제(CACT)라고도 알려진 SLC25A20을 조사했습니다. 주요 기능은 장쇄 아실카르니틴을 미토콘드리아로 운반하여 유리 카르니틴과의 교환을 촉진하는 것입니다. 이들 수송된 아실카르니틴은 이후 카르니틴 팔미토일트랜스퍼라제-2(CPT-2)에 의해 지방 아실CoA로 전환되어 지방산 β-산화의 전구체 역할을 합니다. 실험 결과에 따르면 광선 각화증 약물 Ing-Meb의 농도가 증가함에 따라 세포 장쇄 아실카르니틴 함량이 크게 증가한 것으로 나타났습니다(그림 6에 표시). 이러한 관찰은 SLC25A20에 대한 Ing-Meb의 억제 효과를 강력하게 뒷받침함으로써 SLC25A20이 Ing-Meb의 작용을 매개하는 주요 표적 중 하나임을 확인시켜 줍니다.
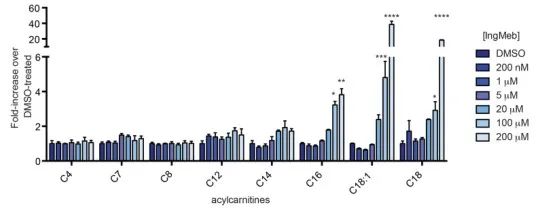
그림 6: 장쇄 아실카르니틴에 대한 Ing-Meb의 효과
5. SLC25A20 발현을 통한 Ing-Meb 세포독성 효과의 간접적 검증: 약물 활성 조절에서 표적 기능 공개.
연구자들은 HeLa 세포에서 SLC25A20의 억제와 Ing-Meb의 잠재적 세포독성 효과를 직접적으로 연관시키려고 했습니다. 결과는 SLC25A20의 과발현이 이들 세포에서 Ing-Meb의 절반 억제 농도를 변경하지 않았지만 SLC25A20 발현의 증가가 Ing-Meb가 장쇄 아실카르니틴 축적에 미치는 영향을 크게 완화했다는 점에 주목할 만합니다(그림 7에 표시됨). . 이 결과는 SLC25A20이 Ing-Meb의 약물 활성에 대한 중추적인 기능적 표적으로 작용한다는 가설을 더욱 입증합니다.
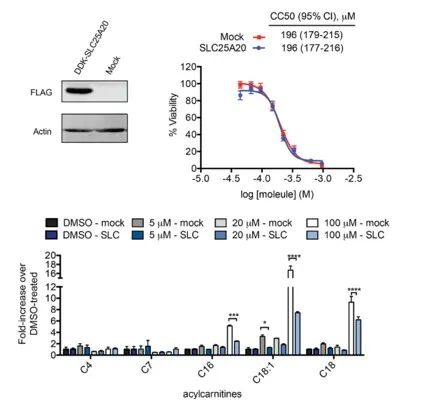
그림 7: CC50 및 아실카르니틴에 대한 SLC25A20의 발현 여부에 따른 효과.
본 연구는 Ing-Meb의 새로운 목표를 밝힐 뿐만 아니라, 구조적으로 복잡한 천연물의 목표 발견을 위한 새로운 이론적 기반과 전략적 방향을 제시합니다. 참조:

