
제품
다루기 힘든 표적을 위한 새로운 납 구조의 화학단백체 발견
기술적 배경
현재 FDA 승인 약물의 표적이 되는 단백질은 ~800개에 불과하며, 질병 관련 표적의 상당수는 "치료할 수 없습니다". 왜냐하면 현재 대부분의 기술은 정제된 단백질에 의존하기 때문입니다. 화학단백체학의 출현은 정제된 단백질에서 살아있는 세포에 이르기까지 약물 발견에 혁명을 일으켰습니다. 인간 프로테옴 규모에서 작은 분자와 단백질 사이의 상호 작용을 정량적으로 분석할 수 있습니다. 이제 시스테인, 라이신, 메티오닌, 티로신과 같은 단백질 표적의 특정 아미노산 잔기에 대한 공유 구조의 발견이 세포 용해물과 살아있는 세포에서 입증되었습니다. ChomiX는 자체 화학단백체학 플랫폼을 활용하여 "견약할 수 없는" 표적의 장벽을 빠르게 돌파할 것입니다.

기술적 장점
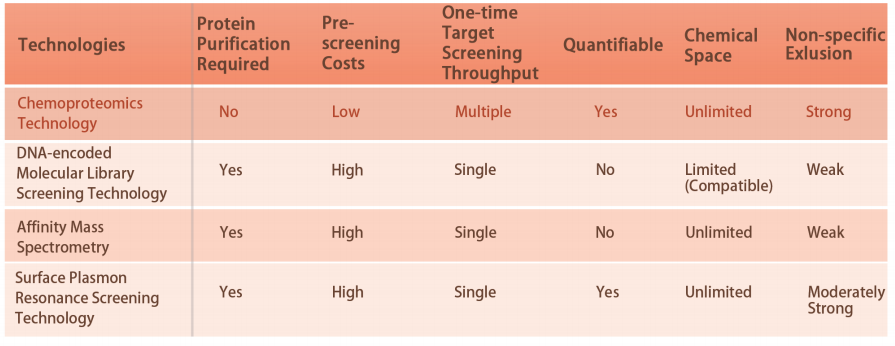
플랫폼 기술적 특징
DIA-ABPP 플랫폼은 시스테인 잔기의 티올 그룹과의 공유 반응을 통해 단백질 표적과 결합하는 공유 결합제를 발견하도록 설계되었습니다. 단백질의 활성 시스테인 잔기가 공유 분자에 의해 우선적으로 점유되면 티올 그룹과 특이적으로 반응하는 보편적인 프로브의 라벨이 경쟁하게 됩니다. DIA 기반 정량적 단백질체학 기술과 결합하여 공유 분자와 대조군 사이의 프로브 표지 펩타이드의 강도를 정량화할 수 있습니다. 이러한 신호 차이는 결합 단백질에 대한 공유 분자의 점유율을 나타냅니다. 기존의 단일 표적 스크리닝 전략과 달리 DIA-ABPP 플랫폼은 아미노산 잔기를 분해하여 단편 친전자체와 살아있는 세포의 거의 모든 단백질 간의 상호 작용을 정량 분석할 수 있어 효율성이 크게 향상되고 처리량이 많은 납 구조 발견 프로젝트의 위험이 줄어듭니다. .

공유결합 납 화합물 스크리닝 작업 흐름
특징 1

당사의 약물 유사 분자 라이브러리에는 아크릴아미드, 클로로아세트아미드 및 알킨아미드와 같은 약한 친전자성 반응성을 특징으로 하는 다양한 반응성 그룹(탄두)이 포함되어 있습니다. 이들 분자는 Lipinski의 5의 법칙을 준수하는 구조적으로 다양한 약리단을 특징으로 합니다.
특징 2

현재 티올 특이적 화학 프로브에 의해 포착된 단백질 표적 라이브러리는 키나제, 포스파타제, 리가제 및 전사 인자를 포함하여 12421개 단백질의 39962개 시스테인 부위를 포괄합니다. 라이브러리는 지속적으로 업데이트되어 특정 대상 및 사이트에 대한 최신 정보에 대한 액세스를 보장합니다. 특정 대상 및 사이트에 대한 자세한 정보는 아래 링크를 통해 확인할 수 있습니다.
특징 3

단일 스크리닝 실험에서 플랫폼은 전체 프로테옴의 모든 표지된 단백질에 대한 소분자(A2-H6)의 표적 결합을 정량화할 수 있습니다. 위 그림은 공유 분자에 의해 선택된 임상적으로 중요한 표적의 부위 점유를 보여줍니다. 색상이 어두울수록 오르토스테릭 및 알로스테릭 부위를 포함하여 결합 포켓에 대한 분자의 점유율이 높아집니다(별표는 점유율이 80%보다 높음을 나타냄). 따라서, 후속 구조 최적화를 위해 각 분자의 친화력과 선택성을 동시에 평가할 수 있습니다.




