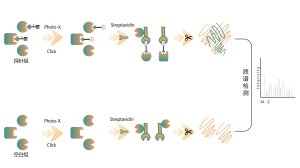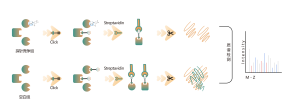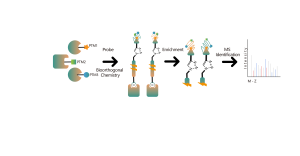제품
세포 내 비공유 소분자 결합 포켓의 식별
플랫폼 기술적 특징
약물 R&D를 위해서는 소분자 약물과 해당 단백질 표적 간의 결합 모드를 결정하는 것이 중요합니다. 구조적 및 물리화학적 수준 모두에서 이러한 상호 작용을 포괄적으로 분석하면 단백질 기능에 대한 이해가 크게 깊어지고 약물 설계 및 최적화가 촉진될 수 있습니다. X선, 저온전자현미경(cryo-EM), 핵자기공명(NMR) 등을 포함한 구조 생물학 기술은 약물 결합 모드를 결정하는 데 널리 사용되어 왔습니다. 단백질-약물 복합체의 고해상도 구조는 초기 단계에서 약물 구조를 최적화하는 데 큰 도움이 될 수 있습니다. 그러나 단백질 구조 분석은 생명 과학 연구, 특히 G 단백질 결합 수용체(GPCR) 및 이온 채널 단백질과 같은 막 단백질 표적에 대해 지속적으로 과제를 제기해 왔습니다. 단백질 정제, 단백질-약물 복합체 결정화 스크리닝, 데이터 수집 및 처리와 같은 프로세스에 상당한 시간과 자원이 소비되는 경우가 많습니다.
이상적인 접근 방식은 살아있는 세포 내에서 단백질-약물 상호 작용 모드를 식별하는 것입니다. 이 접근 방식은 구조 연구와 관련된 높은 비용을 방지할 뿐만 아니라 고염 완충액이나 포화 약물과 같은 인위적인 조건으로 인해 발생할 수 있는 위양성을 제거합니다.

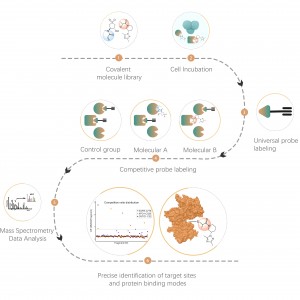
작업흐름

ChomiX는 비공유 소분자 약물에서 파생된 광친화성 화학 프로브를 사용하여 살아있는 세포의 결합 포켓에 위치한 표지된 펩타이드를 포착하고 질량 분석법을 통해 후속 식별을 가능하게 합니다. 일단 펩타이드 서열과 표지된 부위가 결정되면, 분자 도킹의 도움으로 정확한 결합 모드를 빠르게 얻을 수 있습니다.
기술적 장점

사례 연구
프로젝트 목표
약물 B의 추정 표적은 여러 개의 약물 결합 포켓이 보고된 막횡단 단백질입니다. X-ray, cryo-EM과 같은 구조적 생물학적 방법은 실패했습니다. 화학단백체 전략은 살아있는 세포에서 결합 모드를 얻기 위해 시도될 것입니다.
실험방법
광가교결합 및 생체직교 부분을 포함하는 광친화성 프로브 B가 설계되고 합성되었습니다. 약물 B의 표적 결합이 먼저 확인되었고 결합 포켓에 위치한 표지된 펩타이드가 MS에 의해 서열 분석되었습니다.
데이터 시각화

면역블롯 및 MS 기반 화학단백체 데이터를 통해 약물 후보가 프로브 표지 신호에 대해 효과적으로 경쟁할 수 있음이 밝혀졌으며, 이는 약물 후보가 살아있는 세포의 표적 단백질에 직접 결합함을 나타냅니다.

약물 변형 펩타이드에 대한 MS/MS 스펙트럼: CLPFIIGCNPTILH*VHELYIR

MS 기반 화학단백체 데이터 및 분자 도킹을 기반으로 한 약물 결합 모드