ABPP-analyse onthult een nieuw ontstekingsremmend mechanisme van itaconzuur via eiwit-metabolietinteracties
Itaconaat, een endogene metaboliet die cruciaal is voor ontstekingen en immuunregulatie, heeft zijn rol opgehelderd in een gezamenlijk artikel van het ChomiX Biotech-team. De studie maakte op innovatieve wijze gebruik van ABPP-technologie om te onthullen dat itaconaat de S-glycosylatie van cysteïneresiduen op belangrijke glycolytische enzymen modificeert, waardoor het cellulaire metabolisme wordt beïnvloed. Onderzoekers brachten de eiwit-itaconaat-interacties in kaart en ontdekten dat itaconaat direct meerdere enzymen in de glycolyseroute bindt en reguleert, waardoor de snelheid en richting ervan worden beïnvloed. Dit onderzoek vergroot onze kennis van metabolische controlemechanismen tijdens ziektegerelateerde ontstekingen en toont de kracht van ABPP aan in het onderzoeken hoe kleine moleculen eiwitfuncties moduleren. Als leider op het gebied van chemische proteomics biedt Corolus BioScience uitgebreide oplossingen, waaronder sondeontwerp, monsterverwerking, high-throughput screening en data-analyse, om klanten te helpen vergelijkbare metabolische regulerende mechanismen te ontdekken.
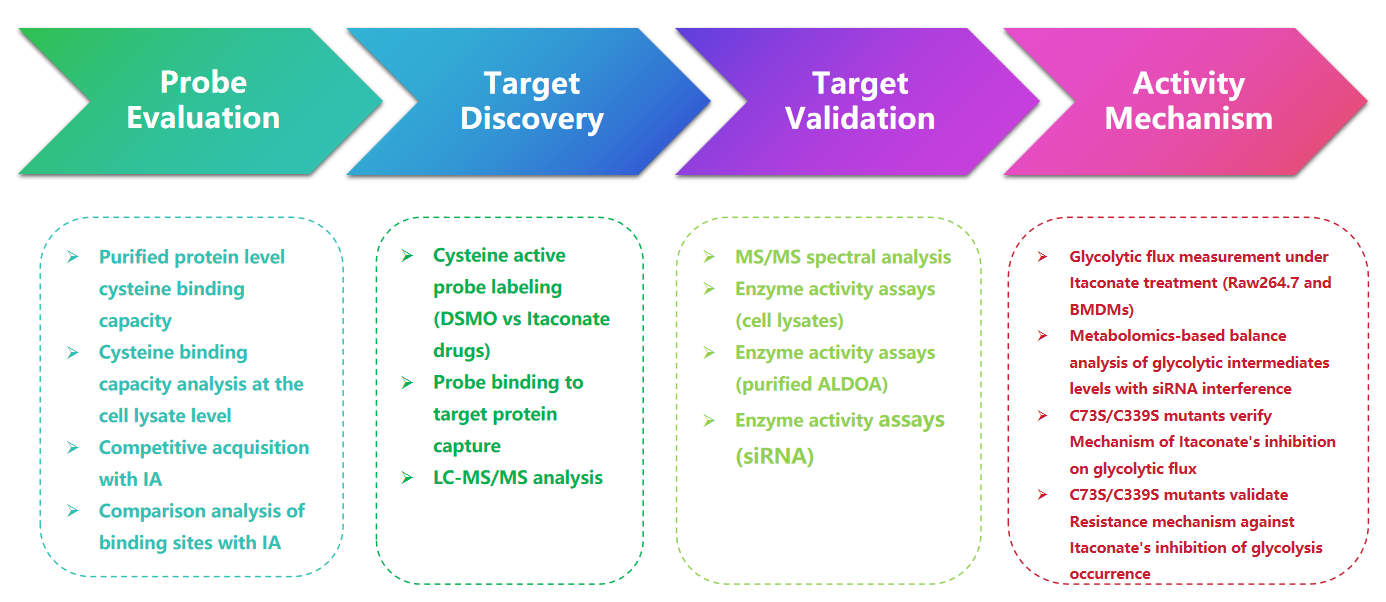
1. Detectie van itaconaatmodificaties met de 1-OH-Az-sonde
In deze studie gebruikten de auteurs geavanceerde profileringstechnieken om op itaconaat gerichte cysteïneresiduen te onderzoeken. Aanvankelijk beoordeelden ze probe 1-OH-Az via gelelektroforese en voerden competitieve experimenten uit met behulp van IA-alkyn. Massaspectrometrievalidatie bevestigde dat 1-OH-Az selectief cysteïneplaatsen labelt, waarbij 87% van de nieuw geïdentificeerde eiwitten niet eerder gedocumenteerd was als ligandbindende eiwitten in DrugBank. Gezien de diverse functies en ziekterelevantie van deze eiwitten, kan de 1-OH-Az-sonde worden gebruikt om actieve cysteïnen te identificeren als potentiële medicijndoelen voor nieuwe therapieën.
Figuur 1: 1-OH-Az als een efficiënte en onderscheidende cysteïne-analysesonde voor het detecteren van itaconaatmodificaties
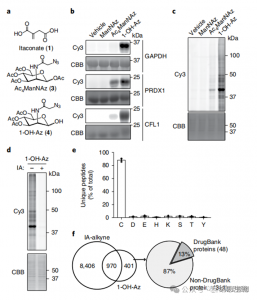
2. Identificatie van Itaconate-modificatielocaties met behulp van kwantitatieve Proteomics-technieken
De onderzoekers voerden isoTOP-ABPP-experimenten uit om cysteïneresiduen te kwantificeren die door itaconaat zijn gemodificeerd met behulp van de 1-OH-Az-sonde. Na voorbehandeling met lysaat werd isotopisch gelabelde, door linker ondersteunde kwantitatieve proteomics gebruikt om de impact van verschillende concentraties itaconaat te analyseren, waarbij de specifieke doelen ervan werden bepaald. Er werden ook vergelijkende experimenten uitgevoerd met behulp van twee concentraties IA-alkyn, die, hoewel ze een bredere activiteit en dekking vertoonden, slechts 65 en 50 effectieve concurrerende sites herkenden. Met name vertoonde 1-OH-Az een aanzienlijk hoger concurrentievoordeel onder co-gekwantificeerde cysteïnes.
Figuur 2: Chemische proteomische analyse van met itaconaat gemodificeerde cysteïnes met behulp van competitieve isoTOP-ABPP met 1-OH-Az
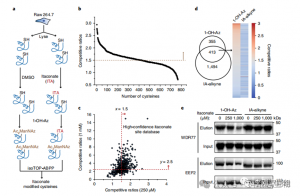
3. Itaconaat wijzigt en remt een belangrijk glycolytisch enzym
Massaspectrometrische analyse onthulde dat itaconaat drie belangrijke glycolytische enzymen modificeert: ALDOA, GAPDH en LDHA. Endogene itaconaatmodificatie op Cys73 en Cys339 van ALDOA werd bevestigd in door LPS gestimuleerde Raw264.7-cellen. Vanwege hun nabijheid speculeerden de auteurs dat dergelijke modificaties de aldolase-activiteit zouden kunnen beïnvloeden. Behandeling met 1 mM itaconaat leidde inderdaad tot verminderde ALDOA-enzymactiviteit zonder de eiwitexpressie te beïnvloeden. Bovendien toonden isoTOP-ABPP-analyses aan dat Cys84 op LDHA en Cys245 op GAPDH ook doelwitten zijn voor itaconaatmodificatie.

Figuur 3: Itaconaat kan de ALDOA-functie wijzigen en aantasten
4. Itaconaat onderdrukt voornamelijk de glycolyse door zich te richten op ALDOA
Om de regulerende rol van ITAC bij inflammatoire macrofaagglycolyse te beoordelen, volgden de auteurs de glucoseconsumptie en lactaatproductie in Raw264.7-cellen voor en na LPS-stimulatie, wat aantoont dat ITAC beide significant verminderde, wat wijst op onderdrukking van de glycolytische functie. Om het effect van ITAC op ALDOA en de daaropvolgende remming van de glycolyse te valideren, hebben ze endogene ALDOA uitgeschakeld met behulp van RNAi en WT of dubbelmutant (C73S/C339S) ALDOA tot overexpressie gebracht in Raw264.7-cellen. Zoals verwacht resulteerde de knockdown van ALDOA in een verminderde glucoseconsumptie en lactaatproductie, waardoor de cellen ongevoelig werden voor ITAC-behandeling. Herintroductie van WT of mutant ALDOA herstelde de metabolische niveaus in onbehandelde cellen; cellen die de mutant ALDOA tot overexpressie brachten, vertoonden echter een verminderde gevoeligheid voor glycolytische remming vergeleken met WT. Enzymatische tests voor aldolase-activiteit afgestemd op glycolytische toestanden.
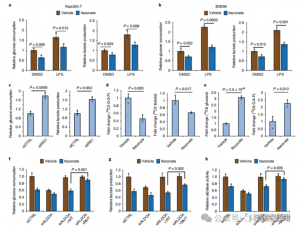
Figuur 4: Itaconaat verandert de glycolytische route via modificatie van ALDOA
5. Remming van ALDOA draagt bij aan ontstekingsremmende reacties
Deze bevindingen onthulden dat ITAC de activiteit van de glycolytische route onderdrukt door cysteïneresiduen Cys73 en Cys339 op ALDOA te modificeren. De auteurs concludeerden verder uit de bekende ontstekingsremmende werking van dimethylfumaraat via cysteïnemodificatie op GAPDH en glycolytische remming dat ITAC op vergelijkbare wijze feedback kan geven om de glycolyse te verstoren en een ontstekingsremmend effect uit te oefenen. Het neerhalen van ALDOA verminderde de IL-1β-secretie aanzienlijk na LPS-stimulatie, wat erop wijst dat het betrokken is bij het reguleren van ontstekingen door middel van glycolyse. Het gedeeltelijk omkeren van de ontstekingsremmende effecten van ALDOA-knockdown met aangevuld pyruvaat duidde op een beperkte rol voor LDHA bij ontstekingsreacties.
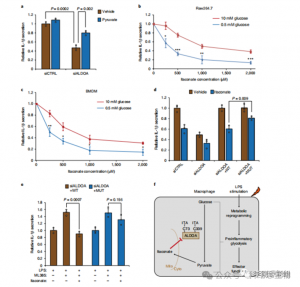
Figuur 5: De ontstekingsremmende werking van Itaconaat wordt gemedieerd door de remming van ALDOA, wat resulteert in verstoring van de glycolyse
Samenvattend heeft dit artikel effectief gebruik gemaakt van op S-glycosylatie gebaseerde cysteïneprofileringstechnologieën en ABPP-methodologieën om een netwerk van interacties tussen itaconaat en gerelateerde eiwitten te construeren. Het toont overtuigend aan dat itaconaat dient als een kritische metabolische regulator door specifiek cysteïneresiduen op eiwitten te modificeren om de glycolytische route te controleren. Dit onderzoek verduidelijkt niet alleen het werkingsmechanisme van itaconaat als een nieuwe metabolische regulator, maar levert ook robuust bewijs voor de manier waarop kleine metabolieten interageren met eiwitten om de belangrijkste metabolische routes te moduleren.
Naast ABPP omvatten andere methoden voor het bestuderen van de interacties tussen metabolieten van kleine moleculen en eiwitten, maar zijn niet beperkt tot:
1. Affiniteitsverrijking (pull-down)technieken, waarbij de natieve verbinding wordt omgezet in een gebiotinyleerde probe die incubeert met cellysaten, gevolgd door door streptavidine gemedieerde verrijking en isolatie van eiwitdoelen die binden aan de biotineprobe.
2.Beperkte proteolyse-massaspectrometrie (LiP-MS)is een doeldetectietechnologie gebaseerd op eiwitaffiniteit. Wanneer specifieke liganden, zoals medicijnen of kleine moleculen, aan bepaalde eiwitten binden, veroorzaken ze conformationele veranderingen of sterische hindernissen die leiden tot verschillende splitsingsplaatsen in vergelijking met het ongebonden eiwit. Door deze verschillen te detecteren met behulp van massaspectrometrie, kan deze methode medicijn-eiwitinteracties in cellen identificeren en de moleculaire doelwitten van het medicijn bepalen.
3.Cellulaire thermische verschuivingstest (CETSA)werd oorspronkelijk ontwikkeld om te helpen bij onderzoek naar doelwitten tegen kanker en is een van de eerste veelgebruikte labelvrije methoden voor het bestuderen van de betrokkenheid van geneesmiddelen in intacte cellen. CETSA berust primair op het principe dat een verbinding bij binding aan een doeleiwit de thermische stabiliteit ervan verhoogt. Na het incuberen van monsters met de verbinding en overeenkomstige controles bij verschillende temperatuurgradiënten, blijven aan het ligand gebonden eiwitten gevouwen en relatief stabiel na verwarming, terwijl ongebonden eiwitten zich ontvouwen en neerslaan als gevolg van denaturatie. Daaropvolgende analyse van de thermostabiliteit van oplosbare eiwitten door middel van immunoblotting of op massaspectrometrie gebaseerde benaderingen, gebaseerd op hun smeltcurven, bevestigt de interactie tussen de verbinding en intracellulaire eiwitten.
4. Affiniteitschromatografieomvat het conjugeren van de doelmetaboliet aan een vaste-fasematrix om eiwitcomplexen te vangen die ermee interageren. De gevangen eiwitten worden vervolgens geïdentificeerd met behulp van technieken zoals massaspectrometrie.
5.Oppervlakteplasmonresonantie (SPR)wordt gebruikt voor real-time, labelvrije meting van kinetische parameters geassocieerd met de interacties tussen kleine moleculen en eiwitten.
6. Eiwitkristallografieverheldert de driedimensionale structuren van eiwitten die zijn gecomplexeerd met liganden van kleine moleculen, waardoor een intuïtief inzicht wordt geboden in de bindingsplaatsen en werkingsmechanismen. Door deze structuren op te lossen, kunnen onderzoekers direct visualiseren hoe de kleine moleculen interageren met hun eiwitdoelen.

