Gebruik van chemische proteomics om het functionele doelwit SLC25A20 van Ingenol-mebutaat voor actinische keratose te identificeren
Deze studie maakt gebruik van chemische proteomics om een nieuw doelwit te onthullen van macromorolmethylbutylaat (Ing-Meb), een medicijn dat wordt gebruikt bij de behandeling van zonnekeratose. Het onderzoeksteam bedacht en synthetiseerde aanvankelijk een Ing-Meb-fotoaffiniteitssonde genaamd Ing-Dayne, die covalente bindingen vormt met doeleiwitten bij blootstelling aan UV-licht, waardoor de identificatie van potentiële functionele doelen wordt vergemakkelijkt. Door daaropvolgende validatie identificeerden de auteurs SLC25A20 als een cruciaal doelwit van Ing-Meb. SLC25A20 is een mitochondriaal membraangebonden carnitine-acylcarnitine-translocase dat betrokken is bij het vetzuurmetabolisme. Met name de remmende werking van Ing-Meb op de SLC25A20-functie leidt tot een verhoogde accumulatie van acylcarnitines met lange keten, wat bevestigt dat Ing-Meb zijn therapeutische effecten teweegbrengt door de vetzuuroxidatieroute te moduleren. Bovendien gaat de studie dieper in op de betekenis van structurele wijzigingen in onderzoek naar natuurlijke producten. Door de fotoaffiniteitssonde van Ing-Dayne te synthetiseren door middel van structurele modificatie van Ing-Meb, hebben de onderzoekers met succes een nieuw doelwit blootgelegd dat verschilt van conventioneel begrip. Dit vergroot niet alleen het begrip van Ing-Meb en zijn werkingsmechanisme, maar onderstreept ook de cruciale rol van structurele modificatie in onderzoek naar chemische proteomics voor het ontrafelen van de complexiteit van natuurlijke producten. Dergelijke inzichten stimuleren de innovatie van geneesmiddelen verder, waaronder de optimalisatie van de bestaande werkzaamheid van geneesmiddelen, de ontwikkeling van nieuwe therapieën die zich op specifieke entiteiten richten, en het ophelderen van mechanismen voor bijwerkingen van geneesmiddelen.
Onderzoeksroute
Experimenteel proces
1. Het ontwerpen van de synthetische Ing-Dayne fotoaffiniteitssonde onthult het mechanisme dat ten grondslag ligt aan de binding van het Actinische Keratosis-medicijn Ing-Meb aan zijn doeleiwit.
In deze studie werd de Ing-affiniteitssonde Ing-Dayne, afgeleid van het therapeutische medicijn Ing-Meb voor actinische keratose, gebruikt (zie Figuur 1). Door dit probemolecuul samen te kweken met specifieke cellen en daaropvolgende bestraling met UV-licht, vormde de dubbele acridinestructuur in de probe stabiele covalente bindingen met intracellulaire eiwitten. Na cellyse vergemakkelijkte een chemische Click-reactie de hechting van de reportergroep azide-tetramethylrhodamine aan het doeleiwit (zoals geïllustreerd in Figuur 2). Daaropvolgende SDS-PAGE-analyse (afgebeeld in Figuur 3) onthulde dat Ing-Meb een significant competitief bindend effect op de probe vertoonde, terwijl Ingenol, dat een vergelijkbare structuur bezat, geen competitieve remming vertoonde.
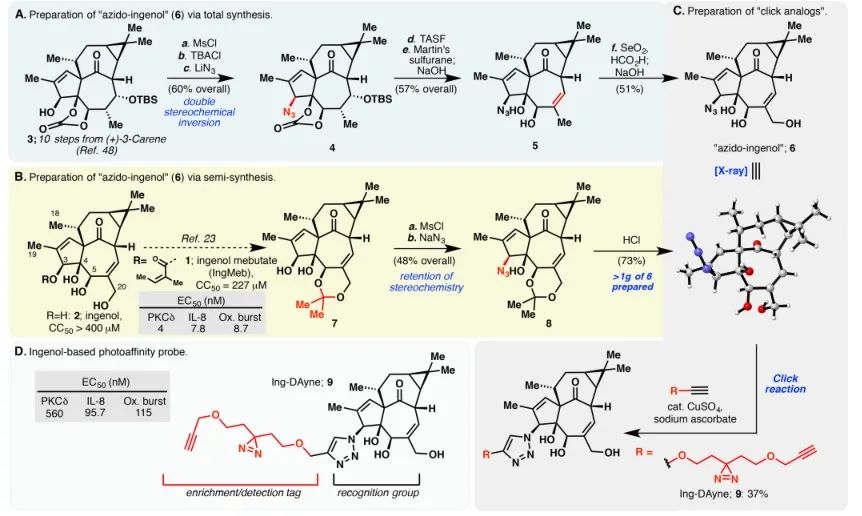
Figuur 1: illustreert de twee synthetische routes die worden gebruikt voor de synthese van Ing-Dayne.
2. De nieuwe probe 11b heeft 44 ontstekingsgerelateerde doeleiwitten van BBR in THP-1-cellen geïdentificeerd en heeft EIF2AK2, eEF1A1, PRDX3 en VPS4B onthuld als directe doelwitten met specifieke interacties met BBR.
De auteurs hebben via een reeks experimenten met succes de nieuwe probe 11b gebruikt om potentiële doeleiwitten in THP-1-cellen te labelen en te zuiveren. Hierna gebruikten ze LC-MS/MS-analyse om 44 ontstekingsgerelateerde eiwitten in het molecuulgewichtsbereik van 20 tot 80 kDa te identificeren, waarvan er zes potentieel een cruciale rol speelden in de ontstekingsremmende werking van BBR. In verder onderzoek werd bevestigd dat EIF2AK2, eEF1A1, PRDX3 en VPS4B directe doelwitten van BBR zijn, die competitieve remmende effecten vertonen onder hoge concentraties BBR-behandeling. Deze bevinding onthulde het waarschijnlijke bestaan van specifieke interacties tussen deze eiwitten en BBR, waardoor nieuwe inzichten werden verhelderd over hun betrokkenheid bij het medicijn tijdens de ontstekingsremmende processen.
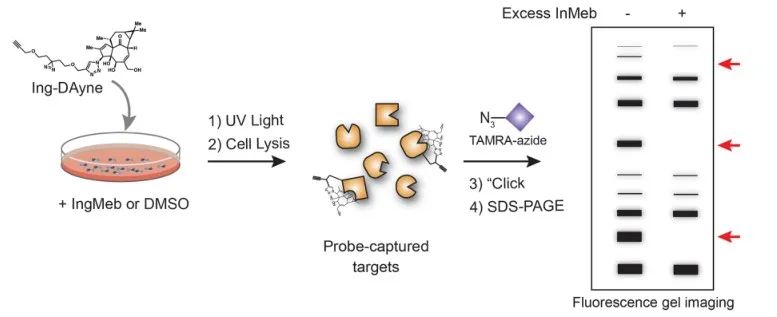
Figuur 2: Op gel gebaseerd validatieproces van het Ing-Dayne-doel.
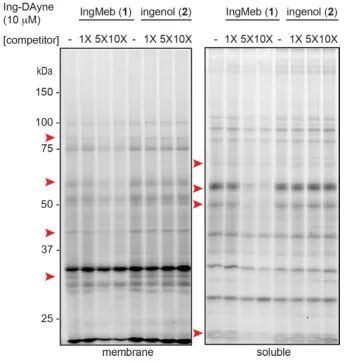
Figuur 3: Competitieve remming van Ing-Meb en ingenol op het probemolecuul Ing-Dayne.
3. SILAC-screening, gecombineerd met Western blot-validatie, identificeerde SLC25A20 als een primair doelwit van het medicijn Ingenol-klasse Ing-Meb.
De auteurs screenden aanvankelijk 28 potentiële doeleiwitten met behulp van Stable Isotope Labeling by Amino Acids in Cell Culture (SILAC) technologie (Figuur 4). Vervolgens constateerden de onderzoekers door middel van verdere screening en Western blot-validatie-experimenten (Figuur 5) dat Ing-Meb het sterkste remmende effect op SLC25A20 vertoonde onder deze kandidaat-doelen, wat er sterk op wijst dat SLC25A20 een van de belangrijkste functionele doelen van Ing-Meb is.
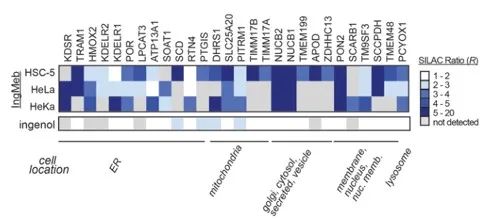
Figuur 4: De 28 potentiële doelwitten verkregen door de eerste screening.
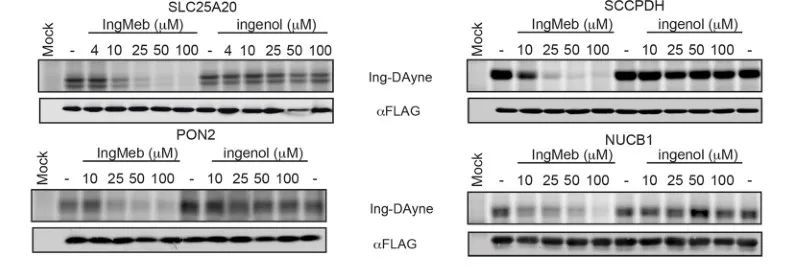
Figuur 5: Western blot-experimenten van vier potentiële doeleiwitten.
4. Ing-Meb reguleert de vetzuuroxidatieroute door SLC25A20 te remmen, een mitochondriaal membraaneiwit dat ook bekend staat als botulinum alkalilipoyltransferase, waardoor zijn doelwit als een medicijn tegen actinische keratose wordt onthuld.
De auteurs onderzochten SLC25A20, ook bekend als botulinum alkali lipoyltransferase of CACT, een multimodaal integraal membraaneiwit gelokaliseerd in het mitochondriale membraan. De primaire functie ervan omvat het transport van acylcarnitines met lange keten naar de mitochondriën, waardoor hun uitwisseling met vrije carnitine wordt vergemakkelijkt. Deze getransporteerde acylcarnitines worden vervolgens door carnitinepalmitoyltransferase-2 (CPT-2) omgezet in vetacylCoA, waardoor ze dienen als voorlopers voor de β-oxidatie van vetzuren. Experimentele bevindingen onthulden een significante toename van het cellulaire acylcarnitinegehalte met lange keten met stijgende concentraties van het Actinische Keratosis-medicijn Ing-Meb (afgebeeld in Figuur 6). Deze waarneming ondersteunt sterk het remmende effect van Ing-Meb op SLC25A20, waardoor SLC25A20 wordt bevestigd als een van de belangrijkste doelwitten die de werking van Ing-Meb bemiddelen.
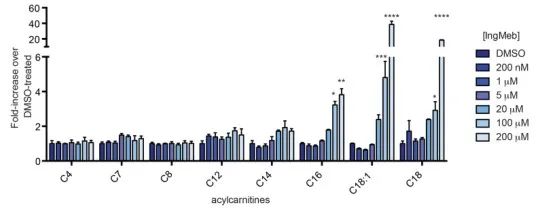
Figuur 6: Effect van Ing-Meb op acylcarnitines met lange keten
5. Indirecte validatie van het cytotoxische effect van Ing-Meb via SLC25A20-expressie: het onthullen van de doelfunctie ervan bij de regulering van de geneesmiddelactiviteit.
De onderzoekers probeerden de remming van SLC25A20 in HeLa-cellen rechtstreeks te koppelen aan de potentiële cytotoxische effecten van Ing-Meb. De resultaten gaven aan dat hoewel overexpressie van SLC25A20 de halve remmende concentratie van Ing-Meb in deze cellen niet veranderde, het opmerkelijk is dat verhoogde SLC25A20-expressie de impact van Ing-Meb op accumulatie van acylcarnitine met lange keten aanzienlijk verzachtte (afgebeeld in Figuur 7). . Deze uitkomst bevestigt verder de hypothese dat SLC25A20 dient als een cruciaal functioneel doelwit voor de medicijnactiviteit van Ing-Meb.
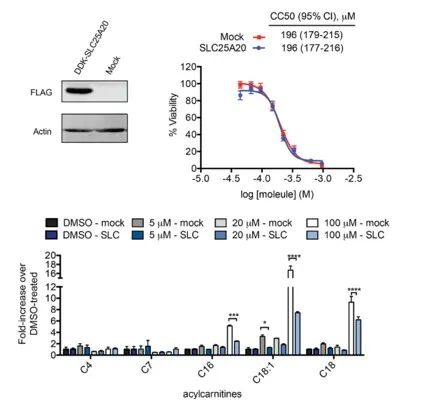
Figuur 7: Effect van wel of niet expressie van SLC25A20 op CC50 en acylcarnitine.
Deze studie onthult niet alleen de nieuwe doelstellingen van Ing-Meb, maar biedt ook een nieuwe theoretische basis en strategische richting voor de doelontdekking van structureel complexe natuurlijke producten. Referentie:
Referentie:https://doi.org/10.1021/acscentsci.7b00420.

