Technische achtergrond
Chemische proteomische technologie komt naar voren als een baken van verandering, waardoor de ontdekking van geneesmiddelen weggaat van gezuiverde eiwitten en richting het rijk van levende cellen.
Chemische proteomische technologie dient als een robuust platform voor het ontdekken van geneesmiddelen, gekenmerkt door het onderzoek naar interacties tussen kleine moleculen en eiwitten in levende cellen. Een van onze covalente geneesmiddelenontdekkingsplatforms is ontworpen om covalente binders te ontdekken die eiwitdoelen aanspreken via de covalente reacties met de thiolgroep van cysteïneresiduen. In tegenstelling tot traditionele screeningstrategieën met één doel maakt het chemische proteomicsplatform kwantitatieve analyse mogelijk van interacties tussen elektrofiele fragmenten en bijna alle eiwitten in levende cellen met de resolutie van aminozuurresiduen. Het biedt dekking voor meer dan 10.000 eiwitten en~40.000 cysteïneplaatsen (potentiële geneesmiddelbindingsplaatsen) uit verschillende zoogdiercellijnen.

Werkstroom
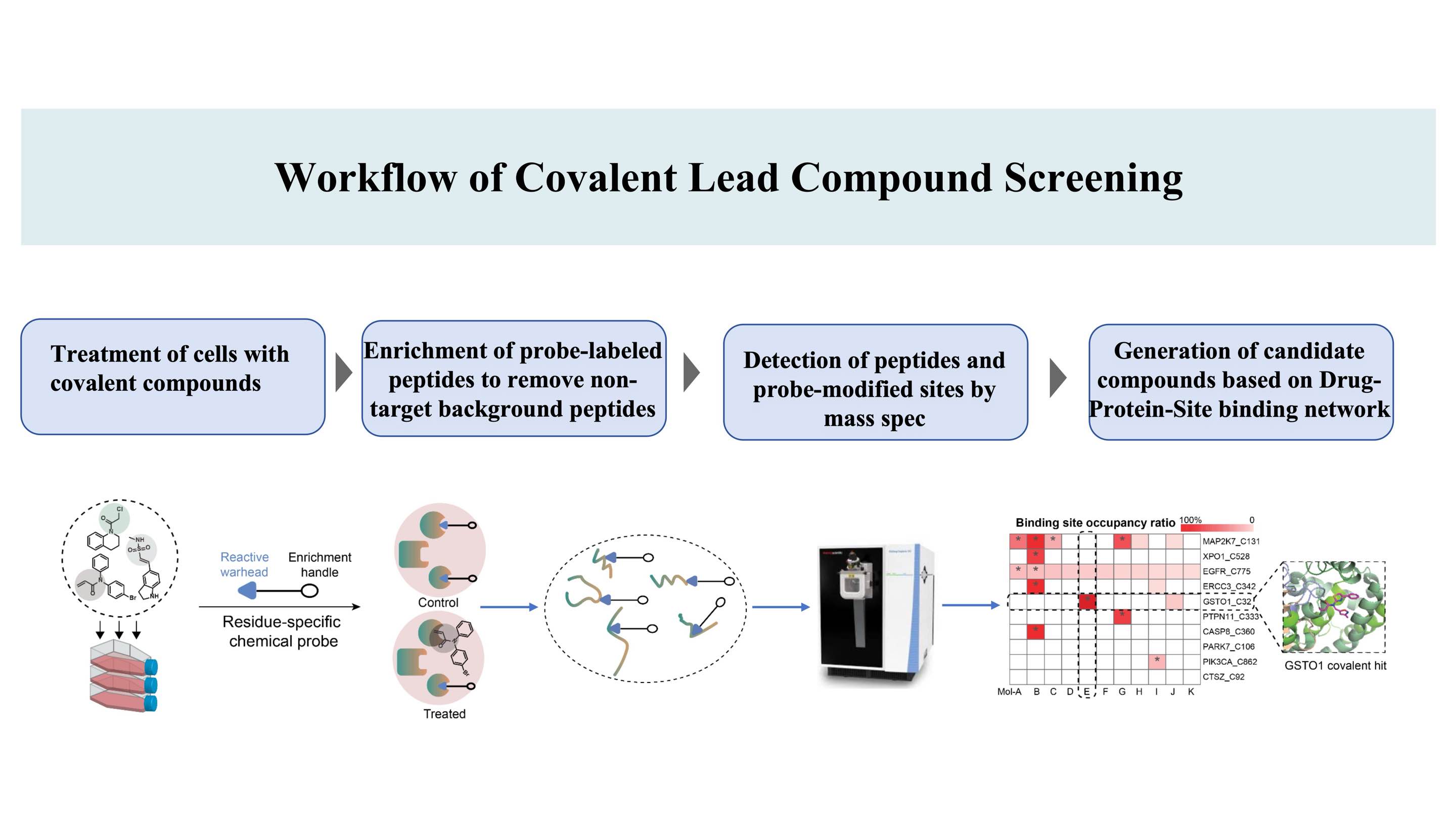
De workflow voor de ontdekking van covalente verbindingen die zich richten op bindingsplaatsen* op eiwitten, gebaseerd op het DIA-ABPP-patent (Data-Independent Acquisition-Activity-Based Protein Profiling) (een covalente bindingsplaats is een aminozuur dat kan worden gelabeld door chemische probes, waardoor ligandeerbaarheid mogelijk wordt)
Technische voordelen
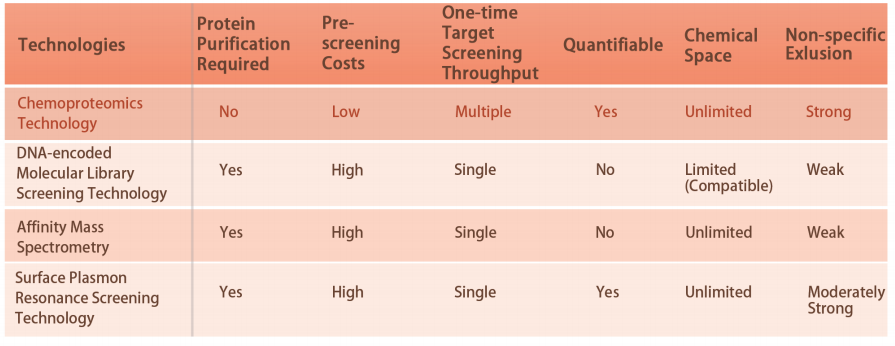
Kenmerk 1
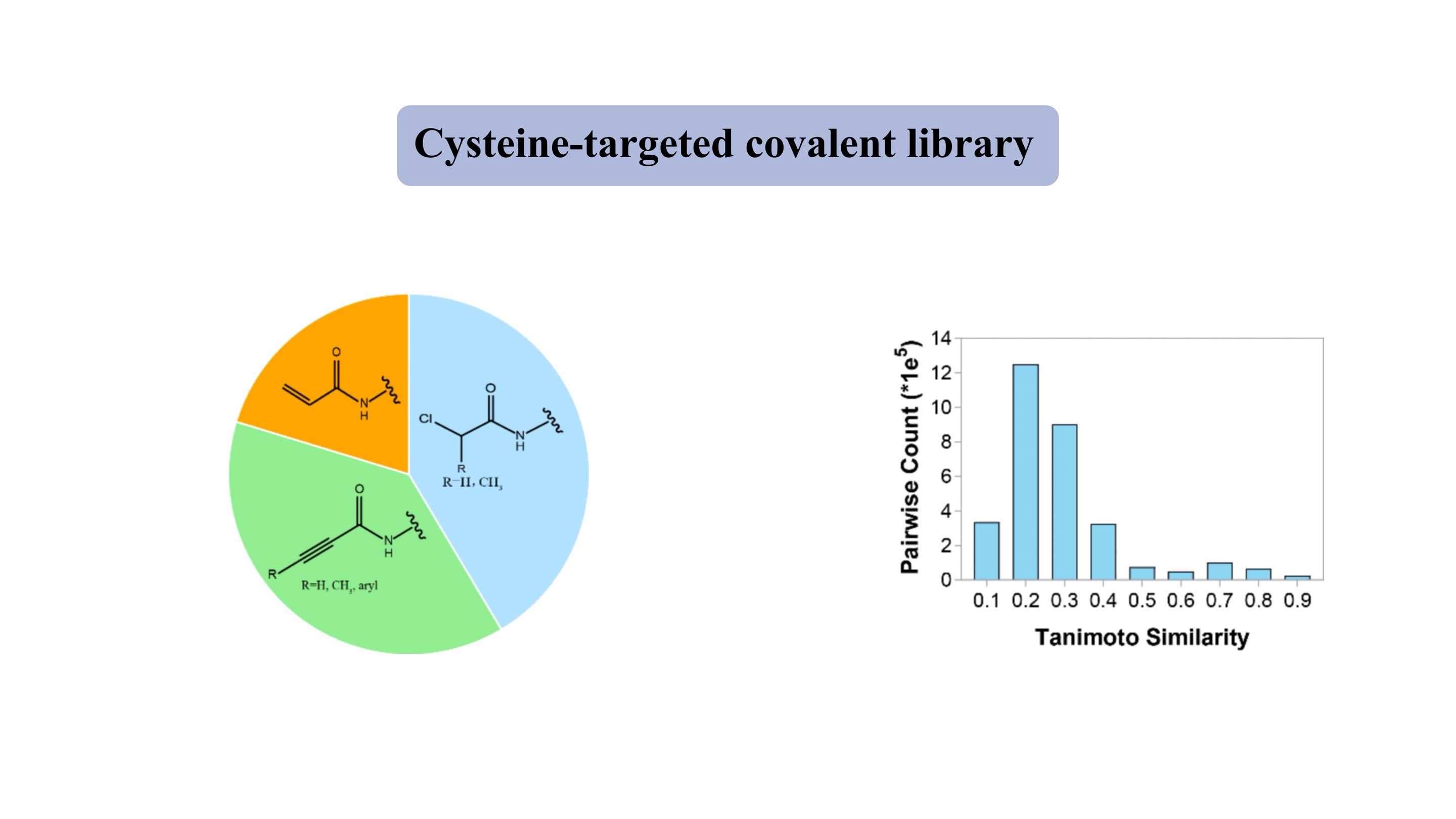
Op cysteïne gerichte covalente bibliotheek
De op cysteïne gerichte covalente bibliotheek bevat representatieve milde elektrofiele “kernkoppen”, zoals acrylamides en chlooraceetamides. De “medicijnachtige” bibliotheek bevat ~3000 verbindingen, waarvan meer dan 80% een molecuulgewicht van 300-500 Da vertoont. Voor de meeste verbindingen bedraagt de Tanimoto-gelijkenisindex ongeveer 0,3 voor elke twee leden, wat wijst op een hoge mate van diversiteit.
Kenmerk 2
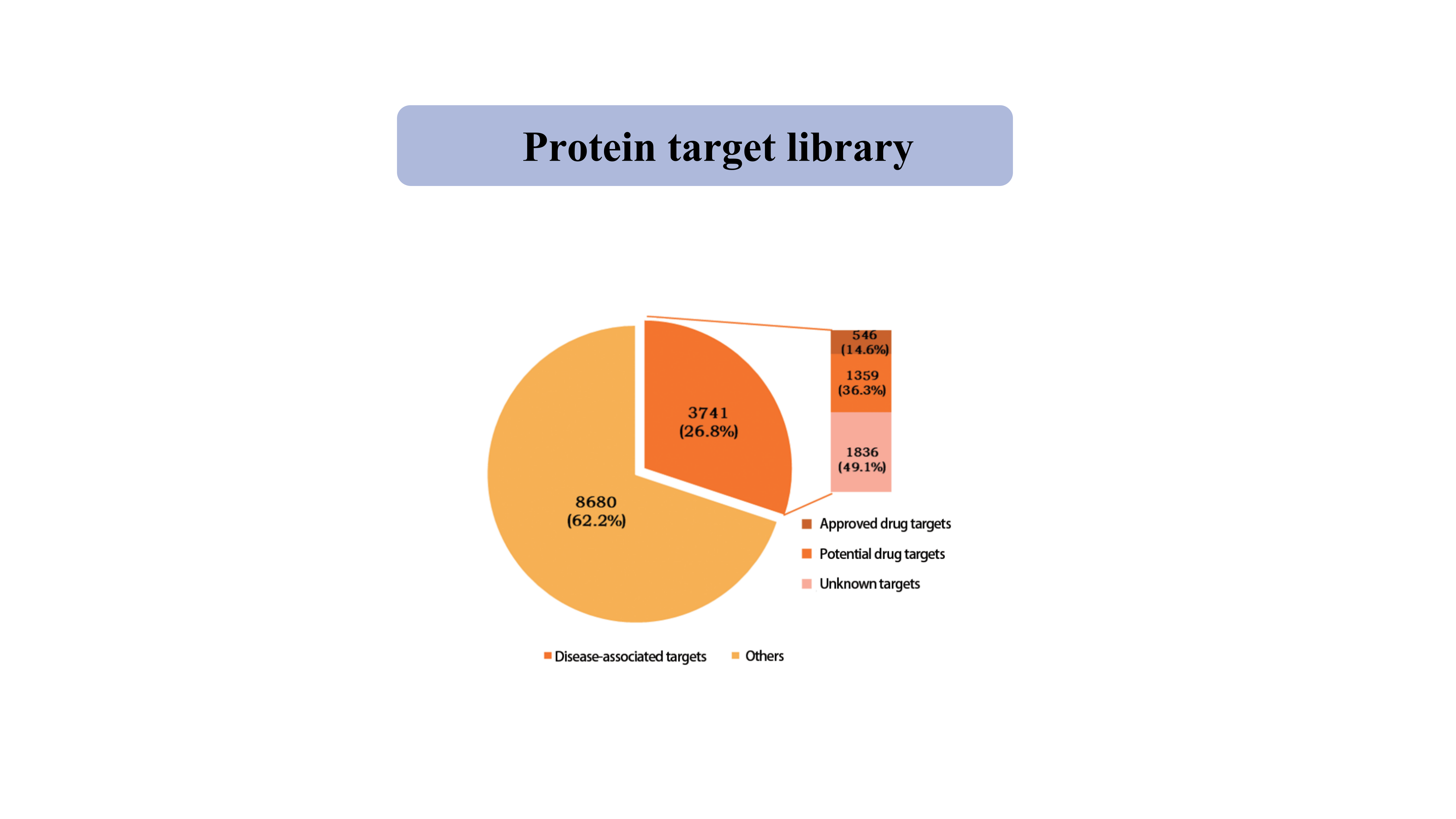
Eiwit doelwitbibliotheek
Momenteel omvat de bibliotheek van eiwitdoelen die door de thiol-specifieke chemische probe zijn gevangen, 39962 cysteïneplaatsen van 12421 eiwitten, waaronder kinase, fosfatase, ligasen en transcriptiefactoren.
Casestudy
DCAF1 dient als substraatreceptor voor twee verschillende E3-ligasen (CRL4DCAF1 en EDVP) en speelt een cruciale fysiologische rol bij de afbraak van eiwitten. Er zijn verschillende covalente en niet-covalente binders ontwikkeld die zich richten op het WDR-domein van DCAF1 om gerichte afbraaktoepassingen te ondersteunen (Targeted Protein Degradation by Electrophilic PROTACs that Stereoselectively and Site-Specifically Engage DCAF1. J. Am. Chem. Soc. 2022, 144, 40, 18688 –18699. Op DCAF1 gebaseerde PROTAC's met activiteit tegen klinisch gevalideerde doelen het overwinnen van intrinsieke en verworven resistentie tegen afbraakproducten.
We ontdekten voor de eerste keer dat Mol-380 covalent samenwerkt met DCAF1_C69, waardoor het wordt benadrukt als een potentiële druggable site voor TPD-toepassingen, los van het WDR-domein. Onze bevindingen benadrukken de aanzienlijke waarde van het ChomiX geautomatiseerde chemische proteomische platform bij het ontdekken van nieuwe liganden voor niet-druggeerbare doelwitten in levende cellen, waaronder transcriptionele factoren en membraaneiwitten, en onderstrepen de potentiële impact ervan op de ontwikkeling van geneesmiddelen en functionele verkenning.
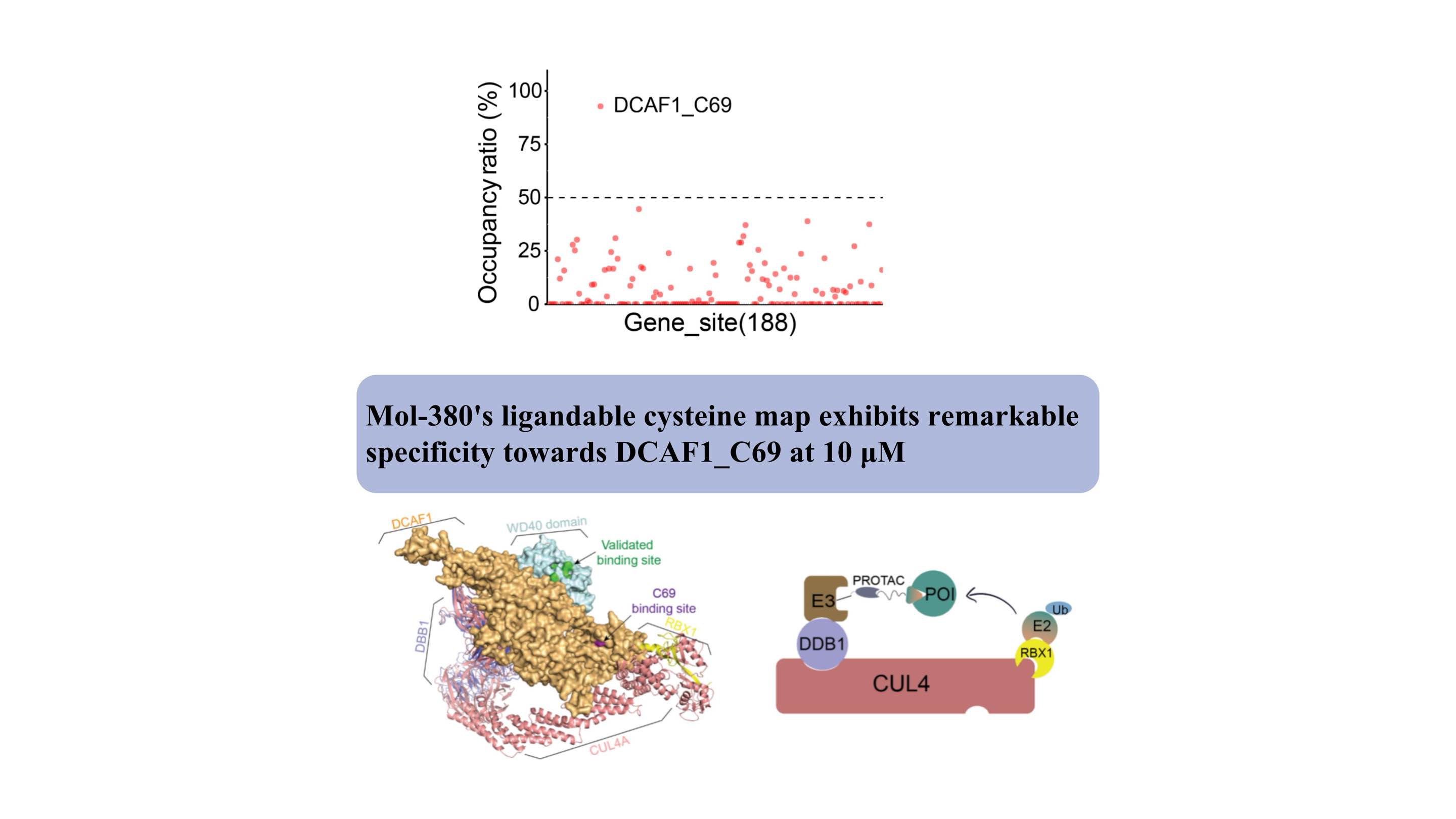
Structureel ligt de bindingsplaats van C69 naast de gevalideerde pocket op het WD40-domein, zoals aangegeven door het complexe model, wat een nieuwe locatie biedt voor de ontwikkeling van PROTAC's.

