
Producten
Chemoproteomische ontdekking van nieuwe leadstructuren voor ondrugbare doelwitten
Technische achtergrond
Momenteel zijn slechts ongeveer 800 eiwitten het doelwit van door de FDA goedgekeurde geneesmiddelen, en een groot aantal ziektegerelateerde doelwitten zijn "niet-mediceerbaar". Omdat momenteel de meeste technologieën afhankelijk zijn van gezuiverde eiwitten. De komst van chemproteomics heeft een revolutie teweeggebracht in de ontdekking van geneesmiddelen, van gezuiverde eiwitten tot levende cellen. Het is in staat om de interacties tussen kleine moleculen en eiwitten op menselijke proteoomschaal kwantitatief te analyseren. Nu is de ontdekking van covalente structuren tegen specifieke aminozuurresiduen van eiwitdoelen, zoals cysteïne, lysine, methionine en tyrosine, aangetoond in cellysaten en levende cellen. ChomiX zal zijn eigen chemoproteomics-platform inzetten om snel de barrières van ‘onherstelbare’ doelen te doorbreken.

Technische voordelen
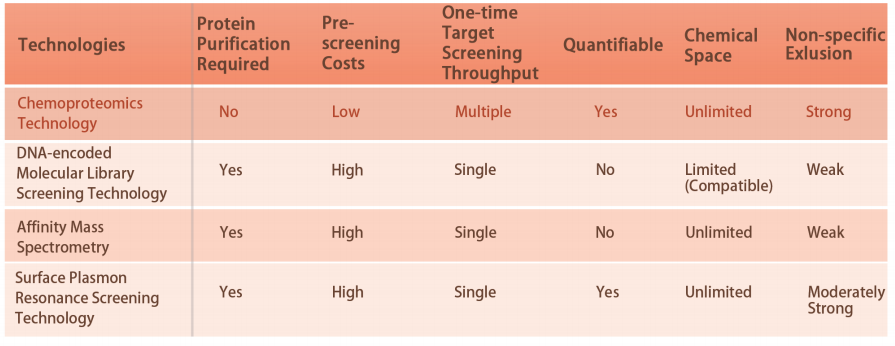
Technische kenmerken van het platform
Het DIA-ABPP-platform is ontworpen om covalente binders te ontdekken die eiwitdoelen aanspreken via de covalente reacties met de thiolgroep van cysteïneresiduen. Zodra actieve cysteïneresiduen van eiwitten bij voorkeur worden bezet door covalente moleculen, zal het label van de universele probe die specifiek reageert met de thiolgroep worden geconcurreerd. In combinatie met op DIA gebaseerde kwantitatieve proteomics-technieken zouden de intensiteiten van probe-gelabelde peptiden tussen het covalente molecuul en de controlegroep gekwantificeerd kunnen worden. Deze signaalverschillen vertegenwoordigen de bezettingsgraad van covalente moleculen tegen hun bindende eiwitten. In tegenstelling tot traditionele single-target screeningstrategieën maakt het DIA-ABPP-platform kwantitatieve analyse mogelijk van interacties tussen fragment-elektrofielen en bijna alle eiwitten in levende cellen met de resolutie van aminozuurresiduen, wat de efficiëntie aanzienlijk verbetert en het risico vermindert voor het high-throughput leadstructuren-ontdekkingsproject .

Workflow van screening van covalente loodverbindingen
Kenmerk 1

Onze bibliotheek met medicijnachtige moleculen bevat een verscheidenheid aan reactieve groepen (kernkoppen) die worden gekenmerkt door milde elektrofiele reactiviteit, zoals acrylamide, chlooraceetamide en alkynamide. Deze moleculen bevatten structureel diverse farmacoforen die voldoen aan Lipinski's Regel van Vijf.
Kenmerk 2

Momenteel omvat de bibliotheek van eiwitdoelen die door de thiol-specifieke chemische probe zijn gevangen, 39962 cysteïneplaatsen van 12421 eiwitten, waaronder kinase, fosfatase, ligasen en transcriptiefactoren. De bibliotheek wordt voortdurend bijgewerkt en garandeert toegang tot de nieuwste informatie over specifieke doelen en sites. Gedetailleerde informatie over specifieke doelen en locaties is beschikbaar via de onderstaande link.
Kenmerk 3

In een enkel screeningsexperiment kan het platform de beoogde betrokkenheid van kleine moleculen (A2-H6) tegen alle gelabelde eiwitten in het hele proteoom kwantificeren. De figuur hierboven toont de locatiebezetting van geselecteerde klinisch belangrijke doelwitten door covalente moleculen. Hoe donkerder de kleur, hoe hoger de bezetting van moleculen om bindingsplaatsen te binden, inclusief orthosterische en allosterische plaatsen (het sterretje geeft aan dat de bezettingsgraad hoger is dan 80%). De affiniteit en selectiviteit van elk molecuul kunnen dus gelijktijdig worden geëvalueerd voor daaropvolgende structuuroptimalisatie.




