[Nationale sleutelprojectfinanciering] Het ontrafelen van metaalbindende eiwitten: METAL-TPP-doorbraken en innovaties op het gebied van de ontdekking van geneesmiddelen
Metaalbindende eiwitten zijn cruciale componenten die stabiele complexen vormen met metaalionen en verschillende vitale functies vervullen in levende organismen, waaronder celsignalering, het katalyseren van biochemische reacties en het handhaven van de homeostase van metaalionen. Hun ontregeling wordt in verband gebracht met ziekten zoals kanker, neurologische aandoeningen en stofwisselingsziekten. Het begrijpen van hun rol in de pathogenese van ziekten is van cruciaal belang voor de diagnose en behandeling. Bovendien zijn metaalbindende eiwitten belangrijke doelwitten bij de ontwikkeling van geneesmiddelen, omdat veel geneesmiddelen ermee interageren om therapeutische effecten uit te oefenen. In deze studie introduceerden onderzoekers METAL-TPP, een ultramoderne chemische proteomics-methode. Door thermostabiliteit kwantitatieve proteomische analyse (TPP) te combineren met identificatie van metaalbindende eiwitten, maakt METAL-TPP een efficiënte en nauwkeurige detectie van metaalbindende eiwitten mogelijk. Het reguleert met name de thermostabiliteit van eiwitten met behulp van een reeks metaalchelatoren, waardoor nauwkeurige identificatie in zuivere eiwitten en cellysaten wordt vergemakkelijkt. Deze innovatieve aanpak biedt nieuwe inzichten in de functie en mechanismen van metaalbindende eiwitten, wat bijdraagt aan biologisch onderzoek, inzicht in ziekten en de ontwikkeling van geneesmiddelen. Keloxi Biology biedt geavanceerde ABPP's, TPP en andere technische diensten op het gebied van farmaceutische R&D, en ondersteunt onderzoekers bij het onderzoeken van medicijnmechanismen en het bevorderen van nieuwe medicijnontwikkelingsprocessen.

Experimenteel proces
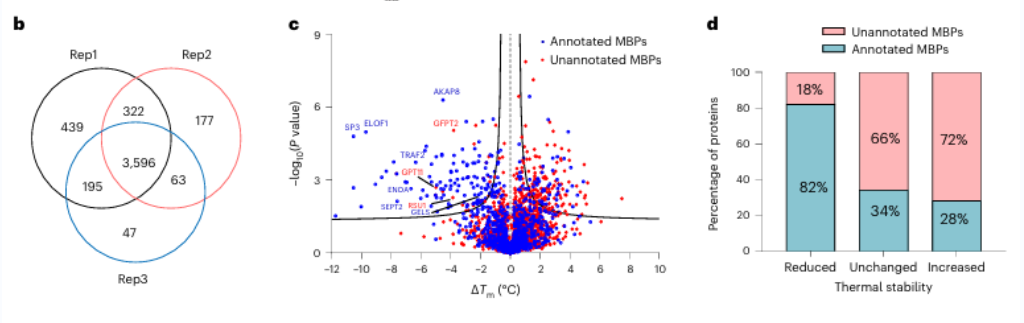
1. Zeventien potentiële metaalbindende eiwitten werden geïdentificeerd met behulp van METAL-TPP.
Aanvankelijk beoordeelden onderzoekers de werkzaamheid van breedspectrummetaalchelatie met behulp van EDTA op zuivere eiwitten en cellysaten. Ze merkten op dat METAL-TPP effectief een vermindering van de thermische stabiliteit van metaalbindende eiwitten detecteerde. Vervolgens werd een systematische analyse uitgevoerd op van mensen afkomstige eiwitten met behulp van METAL-TPP, waarbij 125 eiwitten werden geïdentificeerd die verminderde thermostabiliteit vertoonden. Hiervan waren er 102 eerder bekende metaalbindende eiwitten. Bovendien werden 17 potentiële metaalbindende eiwitten zonder voorafgaande functionele annotatie blootgelegd, wat nieuwe inzichten biedt in de rol van metaalbindende eiwitten.
2. Het effect van zinkionen op het potentiële metaalbindende eiwit GFPT2.
Van deze 17 potentiële metaalbindende eiwitten kozen onderzoekers ervoor om diepgaande biochemische validatie uit te voeren op het eiwit GFPT2. GFPT1/2 fungeert als het eerste snelheidsbeperkende enzym in de hexosebiosyntheseroute en helpt bij het genereren van een stof genaamd UDP-GlcNAc. Onderzoekers bevestigden op cellulair niveau dat zinkionen interageren met GFPT2, waardoor de activiteit ervan wordt geremd. Bovendien merkten ze op dat de aanwezigheid van zinkionen leidt tot een significante verlaging van de UDP-GlcNAc-niveaus, wat erop wijst dat zinkionen de hexose-biosyntheseroute reguleren door de activiteit van GFPT2 te remmen. Interessant is dat zinkionen een verschillende selectiviteit vertonen bij het remmen van de activiteiten van GFPT2 en GFPT1, wat de aanwezigheid van een nieuw regulerend mechanisme suggereert.
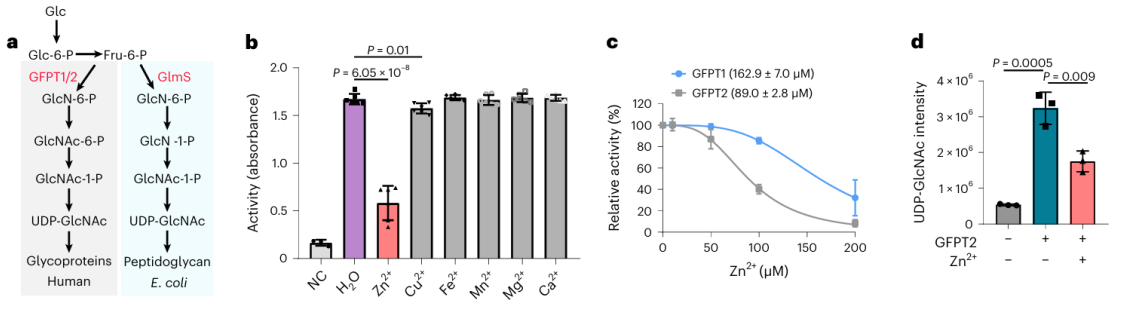
3. Het ontcijferen van het moleculaire mechanisme van zinkionen op de activiteit van GFPT2 en GLMS-enzym.
De onderzoekers isoleerden de homoloog van het GFPT2-eiwit uit E. coli en gingen verder met een reeks biochemische experimenten en kristalstructuuranalyses. Uit de bevindingen bleek dat het GLMS-eiwit het vermogen heeft om zinkionen te binden, en deze binding vindt met name plaats nabij het substraatbindende gebied. Dit suggereert een potentieel scenario waarin zinkionen zouden kunnen concurreren om binding op de actieve plaats van GLMS en GFPT2, of de activiteit van beide enzymen zouden kunnen belemmeren door coördinatiebindingen met hun actieve plaatsen te vormen.

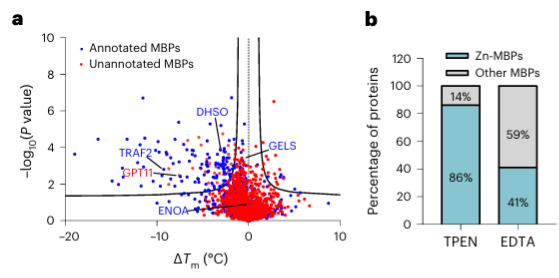
4. De metaalchelator TPEN kan specifiek zinkionbindende eiwitten herkennen.
Ten slotte hebben onderzoekers het vermogen van METAL-TPP uitgebreid om metaalbindende eiwitten in menselijke eiwitten te identificeren met behulp van de metaalchelator TPEN. Uit experimentele resultaten bleek dat van de 150 eiwitten met verminderde thermische stabiliteit er 110 (73%) bekende metaalbindende eiwitten waren, wat aangeeft dat TPEN, net als EDTA, specifiek metaalbindende eiwitten kan herkennen. Hiervan waren 95 (86%) van de bekende metaalbindende eiwitten zinkionbindende eiwitten, terwijl slechts 41% van de eiwitten met verminderde thermische stabiliteit veroorzaakt door EDTA zinkionbindende eiwitten waren, wat erop wijst dat TPEN de voorkeur geeft aan het identificeren van zinkionen. -bindende eiwitten.
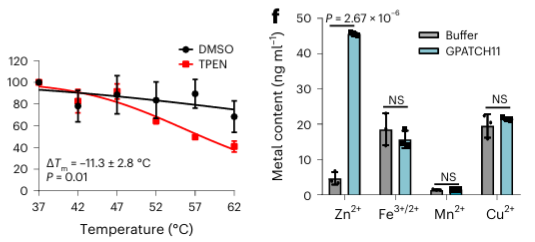
Van de 40 geïdentificeerde potentiële metaalbindende eiwitten selecteerden de auteurs één doeleiwit, GPATCH11, voor voorlopige biochemische validatie en ontdekten dat dit eiwit een zinkionbindend eiwit is.
5. Vergelijking van het herkenningsvermogen van twee metaalchelatoren in METAL-TPP.
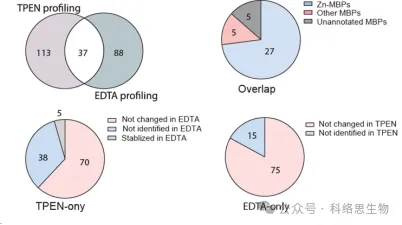
De onderzoekers vergeleken ook het vermogen van twee metaalchelatoren, TPEN en EDTA, om eiwitten met verminderde thermische stabiliteit te identificeren in METAL-TPP-proteomicsgegevens. Ze ontdekten dat van de 37 eiwitten die door beide chelatoren werden geïdentificeerd, er 27 bekend waren dat ze zink binden, 5 bekend waren om andere metalen te binden, en dat 5 voorheen niet-geannoteerd waren als metaalbindende eiwitten. Voor eiwitten waarvan de thermische stabiliteit onder de ene chelator afnam en onder de andere onveranderd bleef of toenam, suggereerden de onderzoekers twee mogelijke redenen voor het verschil in het identificatiebereik met METAL-TPP. Ten eerste kan elke chelator in sommige eiwitten als bindingsligand werken, waardoor ze stabieler worden en het destabiliserende effect dat door metaalbinding wordt veroorzaakt, wordt tegengegaan. Ten tweede hebben de twee chelatoren, vanwege de verschillende moleculaire structuren, ook een sterk verschillende oplosbaarheid in water. Toekomstige METAL-TPP-onderzoeken kunnen dus worden uitgevoerd met behulp van andere chelatoren met unieke moleculaire structuren om de reikwijdte van het metalloproteoom uitgebreider te onderzoeken.
Over het geheel genomen heeft deze studie een nieuwe methode geïntroduceerd, METAL-TPP, die dient als een krachtig hulpmiddel voor het uitvoeren van metaalbindende proteomics-onderzoeken. Door deze aanpak identificeerden onderzoekers systematisch metaalbindende eiwitten en verduidelijkten hun rol in biologische functies en pathogenese. Deze inspanning levert niet alleen belangrijke databases op, maar levert ook waardevolle inzichten op voor het begrijpen van de biochemische functies en het potentieel voor de ontwikkeling van geneesmiddelen van metaalbindende eiwitten, waardoor verder onderzoek op aanverwante gebieden wordt bevorderd.
Referentie:,https://www.nature.com/articles/s41589-024-01563-y.

